XF細胞代謝アッセイを感染症研究に活用した事例
細胞外フラックスアナライザー XFを感染症研究分野で活用し、感染症の治療的ターゲット特定の可能性を示した事例を紹介しています。
ページの先頭に戻る
XFをノロウイルス研究に活用した事例
Agilent Seahorse XF テクノロジーは、宿主-病原体反応をモニターするために、⽣きた細胞のリアルタイムでの重要な機能的計測を提供し、ウイルス侵⼊のメカニズムを明らかにします。そして、潜在的な治療ターゲットに対する洞察を提供します。
Agilent Real-Time ATP Rate Assayを⽤いることにより、マウスのマクロファージ細胞のノロウイルス感染が、解糖とOXPHOSの増加を伴いながら全体的なATP産⽣速度の増加をもたらすことが明らかになりました。しかしながら、より⾼い⽐率の解糖由来のATPが感染細胞で⽣じました。2-デオキシグルコース (2DG) で解糖を阻害することにより、モック感染および感染細胞において解糖由来のATPの⽐率が低下しました。結果は、ノロウイルス感染の間に解糖とOXPHOSが増加するものの、感染の間はOXPHOSよりも解糖が顕著な役割を果たすようであることを⽰しています。
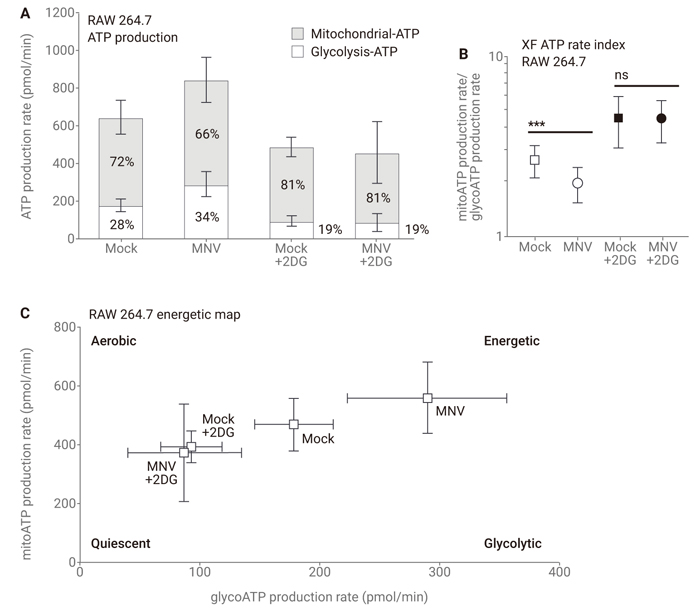
Agilent社 Application Brief "Agilent Seahorse XF Technology Provides Powerful Functional Measurements for Norovirus Research" より引用
ページの先頭に戻る
XFをインフルエンザ研究に活用した事例
Agilent Seahorse XFテクノロジーは、病原体感染に対する代謝的な宿主の先天性免疫応答を計測するために、⽣きた細胞のリアルタイムでの重要な機能的計測を提供し、先天性のT細胞応答を強化するための治療的ターゲットに対する洞察を提供する可能性があります。
Champagne et al. (2016) の研究から、MCJ/DnaJC15タンパク質 (ミトコンドリア内膜に局在するコシャペロン) がインフルエンザウイルス感染に対するCD8+ T細胞の保護応答を増加させる有望な治療的ターゲットである可能性が示唆されています。
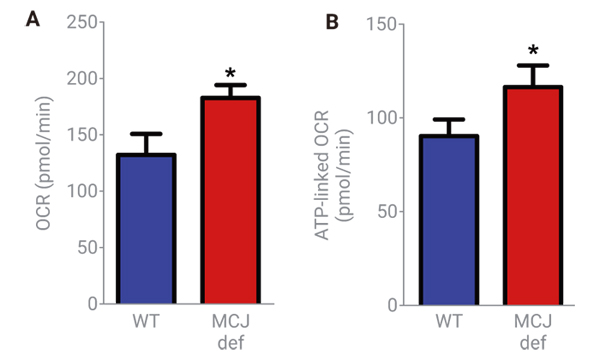
Figure 1. MCJは、naive CD8+ T細胞におけるミトコンドリア呼吸を抑制する。WT (⻘) とMCJに⽋陥があるCD8+ T細胞 (MCJ def、⾚)。新たに単離された細胞の (A) Baseline OCRと(B) ミトコンドリアATP産⽣に関連したOCRをXFミトストレステストで決定した。
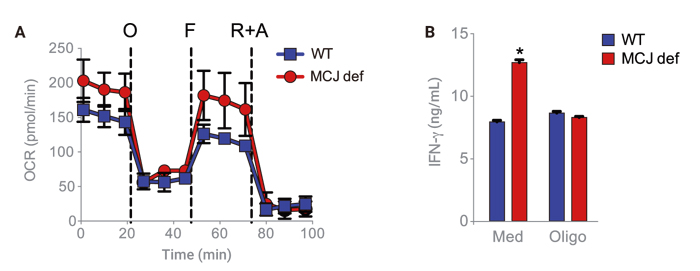
Figure 2. MCJに⽋陥があるエフェクターCD8+ T細胞の酸化的リン酸化の上昇は、 IFN-γ分泌を促進する。WT (⻘) とMCJに⽋陥があるCD8+ T細胞 (MCJ def、⾚) は、抗CD3と抗CD28で2⽇間、活性化させた。(A) ベースラインに12時間静⽌、およびXFミトストレステストのオリゴマイシン(O)、FCCP(F)、ロテノン+アンチマイシン(R+A)に反応した細胞のOCR。(B) 細胞は活性化の最後の4時間オリゴマイシンでインキュベートし、次に4時間休ませた。上清のIFN-γはELISAで決定した。
Agilent社Application Brief "Regulating the Metabolism of CD8+ T Cells Protects Against InfluenzaVirus Infection" から引用
ページの先頭に戻る
XFをRSウイルス研究に活用した事例
RSウイルス (RSV; Respiratory syncytial virus) は乳児における気道疾患の主な原因で、免疫抑制および⾼齢の成⼈の脅威となる呼吸器の病原体であり、毎年世界的にインフルエンザよりも多数の死者を出しています。現在では、有効な抗RSV治療法がなく、このことは、宿主-病原体相互作⽤をより深く理解する必要性を強調しています。
Hu et al. (2019) の研究で、RSウイルスに感染した細胞で微小管・ダイニン依存的なミトコンドリア再分布とミトコンドリア呼吸の阻害が起こること、また、微小管・ダイニン依存的なミトコンドリア再分布およびミトコンドリア活性酸素種(ROS)産生の阻害によりRSウイルス感染が制限されることが示されました。
したがって、宿主細胞のミトコンドリア機能の治療的な調節が、RSV感染に対抗するための潜在的なターゲットとなることが示唆されています。
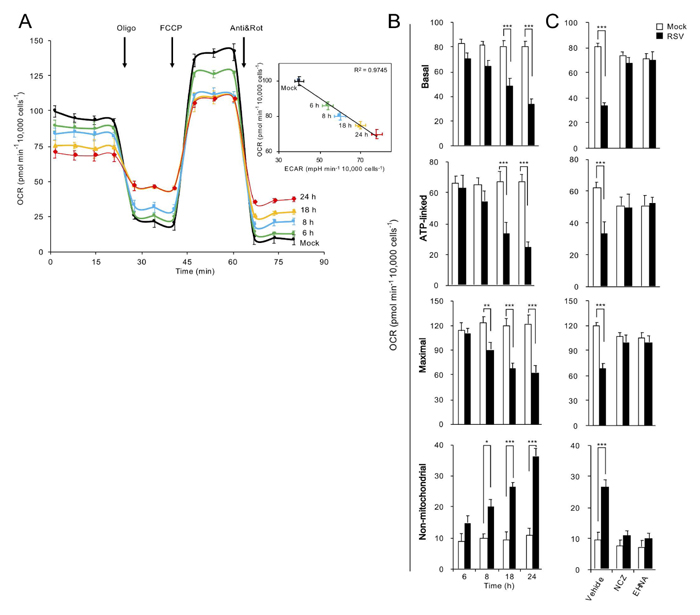
Figure 1. RSV感染は、ダイニン/微⼩管依存的な様式で宿主ミトコンドリア呼吸を阻害する。細胞の⽣体エネルギーの解析は、Agilent Seahorse XF96 細胞外フラックス アナライザーを⽤いて実施した。A549細胞は次のように処理した︓(AとB) 24時間のモック感染、または6〜24時間のRSV感染 (MOI 1)、(C) 微⼩管脱重合剤ノコダゾール (NCZ、17μM) または最後の2時間にわたるダイニンATPase阻害剤 EHNA (200μM)の添加を伴う18時間のRSV感染 (MOI 1) 。(A) これらの実験で得られた典型的な酸素消費速度 (OCR) の例。OCRは、ATP合成酵素阻害剤であるオリゴマイシン (Oligo、1μM)、プロトン・イオノフォアであるFCCP (1μM)、ミトコンドリア複合体III阻害剤であるアンチマイシンA (Anti、1μM) とミトコンドリア複合体I阻害剤であるロテノン (Rot、1μM) の連続した添加の上で、リアルタイムに計測した。挿⼊図︓ミトコンドリア呼吸の計測であるOCRと、解糖の指標である細胞外酸性化速度 (ECAR) の相関 (R2=0.9745)。(BとC) 基底、ATP産⽣、最⼤および⾮ミトコンドリア呼吸のミトコンドリア呼吸機能パラメータを計測した。結果は、独⽴したn=3の、それぞれtriplicateで実施した実験の平均±SEMを⽰す。モック感染細胞と⽐較して、***p <0.001、**p<0.01、*p <0.05。
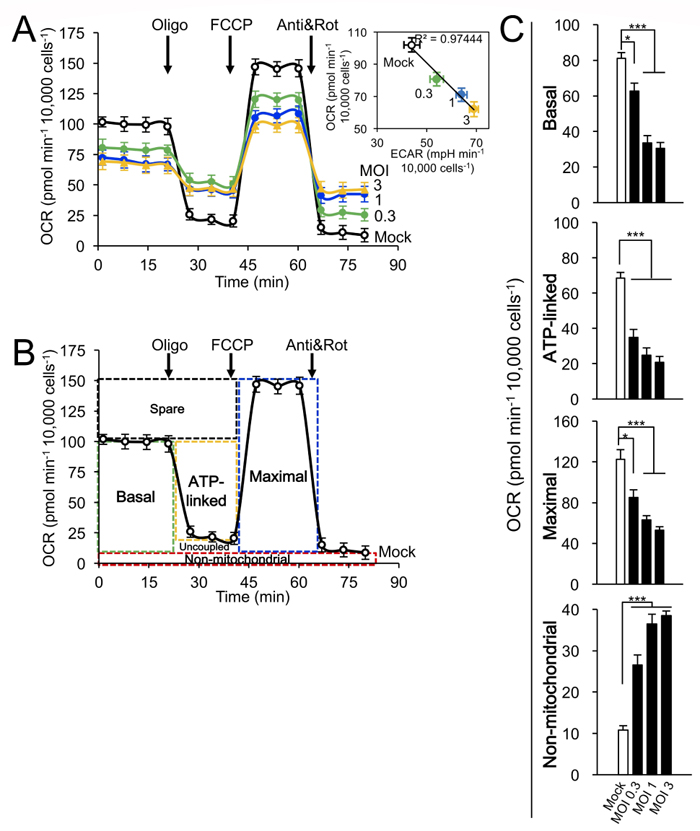
Figure 2. 感染多重度 (MOI) と宿主細胞ミトコンドリア呼吸に対する影響の相関。細胞の⽣体エネルギーの解析は、Agilent Seahorse XF96細胞外フラックスアナライザーを⽤いて実施した。(A 〜 C) A549細胞は、24時間モック感染またはRSV感染させた (MOI 0.3〜3)。(A) 計測/解析は、Figure 1に従って実施した。挿⼊図︓線形回帰によるOCRとECARの相関 (R2=0.97444)。(B) 基底、ATP産⽣、最⼤、⾮ミトコンドリア呼吸パラメータの算出を⽰す概略図。(C) プールされた結果を、Figure 1に従って算出した。モック感染と⽐較して、***p <0.001, *p <0.05。
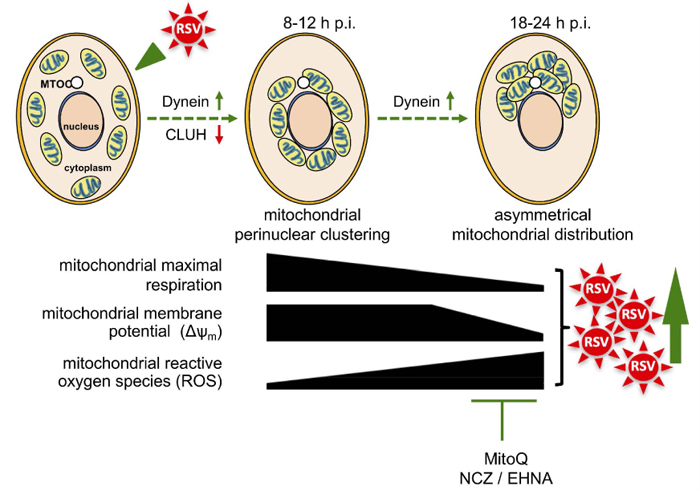
Figure 3. RSV感染を⽀持する進⾏性の宿主細胞の変化の概略図。感染初期 (8〜12h p.i.) のミトコンドリアの核周囲クラスター形成を伴い、RSV感染はミトコンドリア組織の変化を誘発し、その後、感染後期 (18〜24h p.i.) にMTOCの近くにミトコンドリアが⾮対称に分布する。ミトコンドリア再分布の両⽅のフェーズ (上段) は、ダイニン構成要素 (DYNLT1またはDYNC1H1で導かれるsiRNAsによって阻害される) に依存 し、CLUHによって制限される核周囲クラスター形成を伴う (CLUHで導かれるsiRNAは、ミトコンドリアROS産⽣とRSVウイルス産⽣と同様に核周囲クラスター形成を増加させる)。これらの変化を伴って、RSV感染は宿主ミトコンドリア呼吸を阻害し、ミトコンドリア膜電位 (Δψm) の維持を阻害して、ミトコンドリアROS⽣成を増強する。RSV感染性ウイルスの産⽣は、ノコダゾール (NCZ) を⽤いた微⼩管組織の破壊、EHNAによるダイニンモーターの阻害、またはミトコンドリアを標的とした抗酸化剤MitoQの使⽤により減少するため、⽰されているように、これらのイベントはRSV感染を⽀持する。
Agilent社 Application Brief "Investigating Effects of Respiratory Syncytial Virus Infection on Host Cell Mitochondrial Function" より引用
ページの先頭に戻る