タッチパネルで使いやすい
コンパクトなバイタルサインモニター
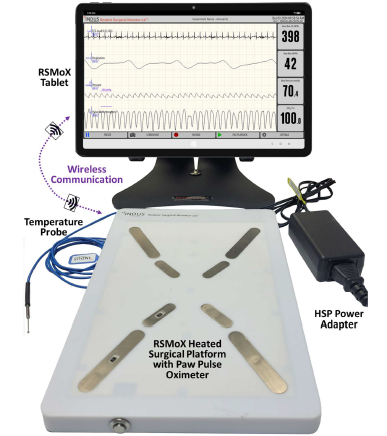
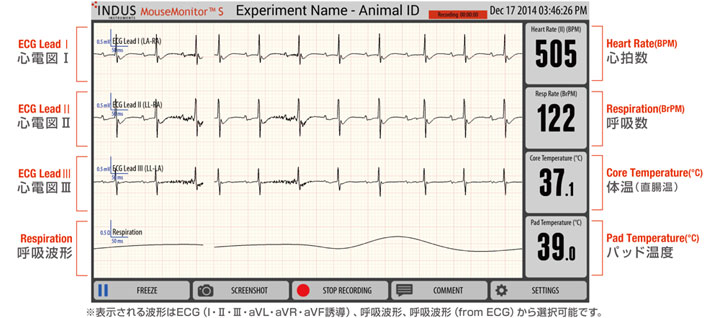
Rodent Surgical Monitor RSM+ / RSM oX は、実験小動物(マウス・ラット等)用に設計されたコンパクトバイタルサインモニターです。動物をA4大のパッドの上に乗せるだけで、心電波形・呼吸波形・心拍数・呼吸数・深部体温(直腸温)・酸素飽和度(SpO2)*・パルスプレチスモグラム*・圧波形**を、12.7インチのタッチパネルモニタに表示・記録します。
*RSM oXモデルの場合、センサー標準搭載。RSM+の場合は、別途センサークリップが必要です。
**圧波形の入力には、圧センサーまたは圧カテーテルが別途必要です。
特長
- タッチパネル上で操作可能
- 温度センサー装備、実験中の動物を保温
- バイタルサインをタッチパネルモニタに表示
- コンパクトな A4サイズのパッド:省スペースで作業可能
| 
|
| |  |
| |
| 内蔵された電熱ヒーターによる安定した保温 |
小動物は麻酔や手術の影響により著しい体温低下を引き起こす恐れがあるため、麻酔下の動物には保温処置を施すことが推奨されます。
従来は、取扱いが面倒な温水循環タイプや、心電図モニタリング装置と電気的な干渉を引き起こすヒートランプが使用されていましたが、RSM+ / RSM oXは、内蔵された電熱ヒーターと温度センサーによって、心電図への信号干渉を防ぎつつ簡便かつ迅速で安全な保温を実現しました。 | | 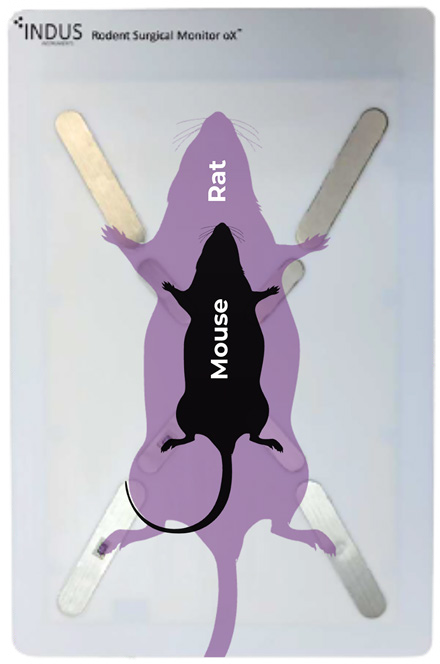
|
|
| |
心電図
- 電極が固定されたパッドを使用しての計測(無侵襲) または外部電極*を使用した計測
(* 外部電極はオプションの針電極が使用可能) - Ⅰ・Ⅱ・Ⅲ / aVL・aVR・aVF 誘導いずれも計測可能
- 仰臥位または腹臥位、頭部の位置(上下)いずれも対応可能
- 電気的に絶縁されたECG増幅器内蔵
- 高分解能24bit シグマデルタ AD 変換器
呼吸
- インピーダンス呼吸曲線記録法に基づく測定
- 電極が固定されたパッドを使用しての計測(無侵襲) または外部電極*を使用した計測
(* 外部電極はオプションの針電極が使用可能)
保温機能・パッド温度モニタリング
- 保温サージカルプラットフォーム(パッド)に、半導体センサを内蔵
- 電子閉ループ温度制御 :内蔵センサーに応じた自動制御
(低い場合:温度を上昇させる、高い場合:温度を下げる) - 効率的な保温領域 (電気保温)
- パッド温度制御 (分解能:0.1℃)
- コンパクト卓上設計 (環流水不要)
- 安全回路付き(事故による動物の過熱を防ぐため、設定に関わらず、パッドのセンサーが47℃以上を検知すると、過温が無効になる仕組みを装備しています。)
※動物の体温は、直腸温を計測します。パッドに内蔵された温度センサは、パッドの保温機能制御のために使用されます。(直腸温センサが動物から抜けてしまったり、断線などがあった場合にも、動物を過熱しないため、このような設計になっています)
| |  |
ページの先頭に戻る
タッチパネルモニタ表示例
(各画像をクリックすると拡大画像がご覧いただけます。)
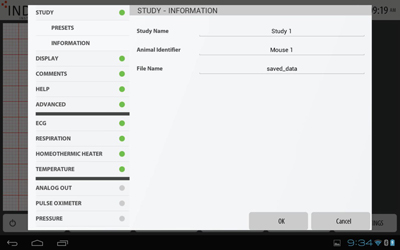 スタディ情報登録
スタディ情報登録実験名・動物ID・ファイル名を登録します。
タッチスクリーン・キーボードが表示されます。
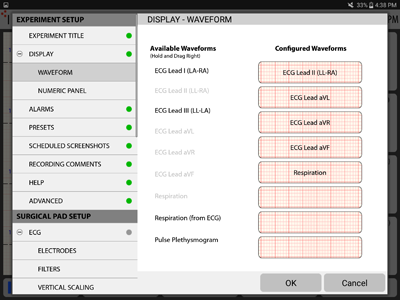 波形表示設定
波形表示設定ディスプレイに表示する波形・順番を選択します。
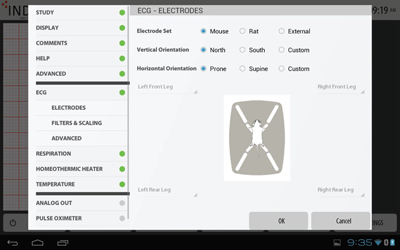 ECG電極設定
ECG電極設定動物の配置(仰臥位または腹臥位、頭部の向き(上下))を、イラストを確認しながら設定します。
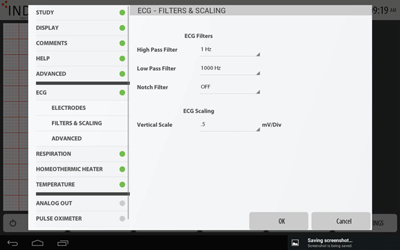 ECGフィルター・スケール設定
ECGフィルター・スケール設定心電図用のフィルター・スケール設定です。
High-Pass・Low-Pass・Notchのフィルター設定、心電図の垂直方向スケール(mV/Div)の設定を行うことができます。
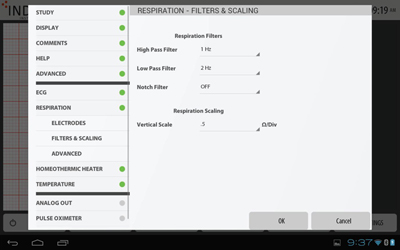 呼吸フィルター・スケール設定
呼吸フィルター・スケール設定呼吸用のフィルター・スケール設定です。
High-Pass・Low-Pass・Notchのフィルター設定、呼吸波形の垂直方向スケール(Ω/Div)の設定を行うことができます。
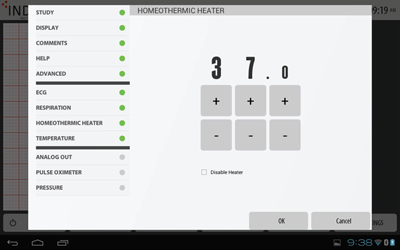 ヒーター設定
ヒーター設定パッドの保温温度を設定します。
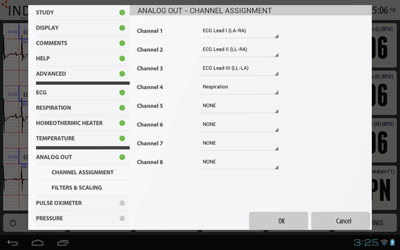 アナログ出力設定
アナログ出力設定アナログ出力する項目を最大8種類まで選択設定します。
(ECG波形:Ⅰ・Ⅱ・Ⅲ・aVL・aVR・aVF、呼吸波形、呼吸波形(fromECG))
ページの先頭に戻る
アクセサリ
ページの先頭に戻る
仕様
| 保温サージカルプラットフォーム部 |
| ECG電極 | 四肢電極 (RA・LA・LL・RL)
外部電極入力
[4極 3.5mm オーディオジャック
(13mm ステンレススチール製針電極 x4本)] |
| 保温ヒーター機能 | 電気加温(マルチゾーン)、保温均一性:<0.5℃、
スタートアップ時間:<2分(室温から)、
設定温度:25~43.5℃(0.1℃きざみの設定可能)
|
| サイズ(W×L×T) | 約19.3×29.5×1.9 cm |
| 重量 | 約880 g |
| タッチディスプレイユニット |
| ディスプレイ | 12.7インチタブレット |
| 解像度 | 1840 x 2944 pixels |
| 電源 | ユニバーサルアダプタ(100-240 V AC) |
| プラットフォームとの接続 | ワイヤレスまたは有線 [ USB-C(オプション)] |
| ソフトウェア機能 | フィルター設定:ハイパス・ローパス・ノッチフィルター
(ECG/呼吸/酸素飽和度/圧 ※圧はローパス・ノッチのみ)
スクリーンショット機能、ファイル再生機能、CSV形式出力 |
| 直腸温プローブ |
| プローブの種類 | マウス、ラット、新生児マウス用 |
| センサータイプ | Tタイプ銅-コンスタンタン熱電対 |
| 精度 | +/- 0.1℃ (校正後) |
| 構成品 |
Rodent Surgical Monitor RSM+ / RSM oX プラットフォーム
12.7インチ タッチディスプレイユニット
電源アダプタ・ケーブル
直腸温プローブ×1本
コットンチップアプリケーター(綿棒)
サージカルテープ
ECG電極用電導クリーム
取扱説明書
※タッチディスプレイユニットは、予告なく仕様が変更になる場合がございます。予めご了承ください。 |
計測・算出パラメータ | 波形 | ECG Ⅰ・Ⅱ・Ⅲ・aVL・aVR・aVF 誘導 |
| 呼吸波形 |
| 呼吸波形(fromECG) |
| パルスプレチスモグラム |
| 圧波形 |
| 数値算出 | 心拍数
(Ⅰ・Ⅱ・Ⅲ誘導) | 30 - 960 BPM |
| 呼吸数 | 15 - 300 BrPM |
| 深部体温 | 25 - 50 ℃(精度:0.1℃) |
| パッド温度 | 25 - 43.5 ℃* |
| 酸素飽和度 | 80 - 100 % |
R - R間隔
(Ⅰ・Ⅱ・Ⅲ誘導) | 62.5 - 2000 ms |
| 圧力 | - 50 - 300 mmHg |
* 47℃で安全装置作動 | アナログ出力・トリガーケーブル |
| BNC出力 ch数 | 4ch・8ch |
| サンプリングレート | 4 KHz |
| DAC分解能 | 16 bit |
| 出力インピーダンス | 75 Ω(標準) |
| 出力電圧 | +/- 5 V |
| 最大出力電流 | 30mA (短絡電流) |
| スルーレート | 1.8V / µs |
| 整定時間 | 5 µs (標準) |
| 直線性誤差 | +/- 1 LSB |
ハイパスフィルター
| Off、0.2Hz、0.5Hz、1Hz、2Hz、5Hz、10Hz |
| ローパスフィルター | Off、1Hz、2Hz、5Hz、10Hz、20Hz、30Hz、100Hz、200Hz、500Hz、1000Hz |
| ノッチフィルター | 50Hzまたは60HzのAC電源ラインノイズを抑制 |
※外観及び規格は予告なく変更することがありますので予めご了承ください。
ページの先頭に戻る
References
In Vivo Cardiac Electrophysiology in Mice: Determination of Atrial and Ventricular Arrhythmic Substrates
Jose Alberto Navarro-Garcia, Florian Bruns et al.,CURRENT PROTOCOLS, Mouse Biology Section, First published: 19 February 2024, doi.:10.1002/cpz1.994
Wavelet analysis of laser speckle contrast reveals new feature space for transcranial assessment of cerebral blood flow
Nadezhda Golubova, Elena Potapova et al., Translational Biophotonics: Diagnostics and Therapeutics III Technical Digest Series (Optica Publishing Group, 2023), paper 1262711, doi.:10.1117/12.2667818
Cardiac muscle–restricted partial loss of Nos1ap expression has limited but significant impact on electrocardiographic features
Alexa Smith, Dallas Auer, et al., G3 Genes|Genomes|Genetics, jkad208, doi.: 10.1093/g3journal/jkad208
Nanowired human cardiac organoid transplantation enables highly efficient and effective recovery of infarcted hearts
YU TAN, ROBERT C. COYLE, et al., SCIENCE ADVANCES, 4 Aug 2023, Vol 9, Issue 31, doi.: 10.1126/sciadv.adf2898
Cardiogenic control of affective behavioural state
Brian Hsueh, Ritchie Chen, et al.,Nature volume 615, pages292–299 (2023), doi.:10.1038/s41586-023-05748-8
Vaccine-linked chemotherapy improves cardiac structure and function in a mouse model of chronic Chagas disease
Kathryn M. Jones, Elise N. Mangin et al., Front. Cell. Infect. Microbiol., 09 February 2023, Volume 13 - 2023, doi.:10.3389/fcimb.2023.1106315
Localized cardiac small molecule trajectories and persistent chemical sequelae in experimental Chagas disease
Zongyuan Liu, Rebecca Ulrich vonBargen et al., Nat Commun. 2023; 14: 6769.Published online 2023 Oct 25. doi: 10.1038/s41467-023-42247-w
Riding the wave: a quantitative report of electrocardiogram utilization formyocardial infarction confirmation
Philip Broughton, Miguel Troncoso, et al.,Am J Physiol Heart Circ Physiol323: H378–H387, 2022 doi.:10.1152/ajpheart.00201.2022
Surface engineering enhances the therapeutic potential of extracellular vesicles following acute myocardial infarction
Kyle I. Mentkowski, Touba Tarvirdizadeh, et al.,bioRxiv, doi.:10.1101/2022.01.31.478512
Extracellular vesicle microRNA cargo engineering reveals critical mechanisms underlying therapeutic efficacy
Lindsey M. Euscher, Kyle I. Mentkowski, et al., bioRxiv, doi.:10.1101/2022.01.31.478505
Differences in Cardiac Effects of Venoms from Tentacles and the Bell of Live Carukia barnesi: Using Non-Invasive Pulse Wave Doppler
Mark Little, Peter Pereira, and Jamie Seymour, Toxins 2021, 13, 19. doi.:10.3390/toxins13010019
Decreased bioavailability of hydrogen sulfide links vascular endothelium and atrial remodeling in atrial fibrillation
Megan Wattsa, Gopi K.Kolluru, et al., Redox Biology, Volume 38, January 2021, 101817, doi:10.1016/j.redox.2020.101817
Pharmacological depletion of microglia prevents vascular cognitive impairment in Ang II-induced hypertension
Danielle Kerkhofs, MD, Britt T. van Hagen, et al., bioRxiv, doi.:10.1101/2020.01.24.916650
Electrophoretic large volume sample stacking for sensitive determination of the anti-microbial agent pentamidine in rat plasma for pharmacological studies.
Tůma P, Heneberg P, Vaculín Š, Koval D. Electrophoresis, elps.201700440, InPress, 2018. PMID:29292827
Cardiac-specific inactivation of LPP3 in mice leads to myocardial dysfunction and heart failure.
Chandra M, Escalante-Alcalde D, Bhuiyan MS, et al. Redox Biol, 14:261-271, 2018. PMID:28982073
Combined angiotensin receptor-Neprilysin inhibitors improve cardiac and vascular function via increased NO bioavailability in heart failure.
Trivedi RK, Polhemus DJ, Li Z, et al. J Am Heart Assoc, 7(5).pii:e008268, 2018. PMID:29502102
Glibenclamide and therapeutic hypothermia have comparable effect on attenuating global cerebral edema following experimental cardiac arrest.
Nakayama S, Taguchi N, Isaka Y, et al. Neurocrit Care, 29(1):119-127, 2018. PMID:29150777
RNase alleviates neurological dysfunction in mice undergoing cardiac arrest and cardiopulmonary resuscitation.
Ma Y, Chen C, Zhang S, et al. Oncotarget, 8(32):53084-53099, 2017. PMID:28881795
Possible role of interaction between PPARa and cyclophilin D in cardioprotection of AMPK against in vivo ischemia-reperfusion in rats.
Barreto-Torres G, Javadov S. PPAR Research, 2016: 9282087, (2016). PMID: 27051413
ページの先頭に戻る
オンデマンドWebinar
『
前臨床研究における重要な視点:実験小動物の麻酔とバイタルモニタリングの最新情報』

(ライブ実施日:2023/11/16)
前臨床研究において用いられる実験小動物、特にマウスやラット、ハムスターといった小型げっ歯類に全身麻酔を施す際は、過麻酔や体温低下による死亡事故や覚醒後の予後不良のリスクを抑制するために、心拍数や呼吸、体温といったバイタルサインを適切にモニタリングすることが推奨されています。
本セミナーでは、国立国際医療研究センター研究所動物実験施設 岡村匡史 先生をお招きし、基礎研究における小型げっ歯類の麻酔法とその有用性についてご講演いただきます。また、弊社プライムテックが取り扱うバイタルモニタリングソリューションについてもご紹介いたします。
▼演題1
『
小型げっ歯類の麻酔法 〜実験目的に沿った麻酔薬の選択〜』
岡村 匡史先生 (国立国際医療研究センター)
(要旨)
全身麻酔は、薬物を中枢神経に作用させることで、可逆的に鎮痛、筋弛緩、意識の喪失ならびに自律神経反射を喪失した状態にし、手術時の肉体的および精神的苦痛を取り除くために実施される。麻酔に用いる薬物は全ての作用を均一に持っていないため、通常は作用点が異なる様々な鎮静薬・鎮痛薬などを併用する。また、麻酔薬は少なからず実験データに影響を与えることから、実験者は実験目的、手術の侵襲度を考慮し、適切な麻酔薬を選択する必要がある。
注射麻酔薬は麻酔薬の投与後の麻酔深度調整が難しいとされてきたが、作用時間が短い麻酔薬や拮抗薬を使用することで、麻酔深度の調節も比較的容易になった。吸入麻酔薬は、マウス・ラット専用の気化器が開発されたことでより使いやすくなり、X線CT装置や超音波装置を用いた撮影時の不動化、さらには麻酔下で採血やtail biopsyを行うと、動物への苦痛を軽減するだけでなく、作業効率が高まり、かつ咬傷などのリスクを軽減することができる。
実験目的に沿った麻酔薬を選択するためには、各麻酔薬の特徴を知っておく必要があり、本セミナーでは、マウス・ラットで使用される麻酔薬について、実例を挙げて概説したい。
▼演題2
『
実験小動物専用にデザインされたバイタルモニタリングシステムの活用』
田邉 充樹 (プライムテック株式会社)
(要旨)
小型げっ歯類における最新の非侵襲モニタリングシステムを2つご紹介します。これらの革新的なモニタリングシステムにより、小型げっ歯類の安全な麻酔管理、麻酔下および覚醒下の生理学計測における正確性と妥当性を高める活用事例についてご紹介します。
※画像をクリックすると、別タブが開きます。お客様情報をご入力の上、視聴下さい。
ページの先頭に戻る