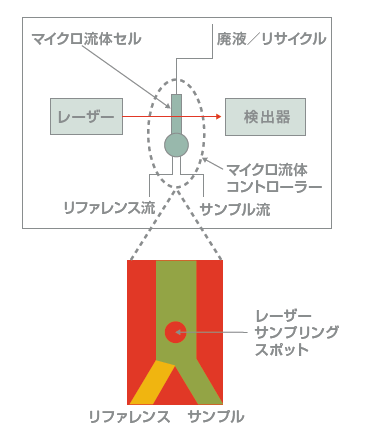
中赤外レーザーを用いて AmideIバンド(1590~1710cm
-1)における差分吸光度を測定し、タンパク質二次構造の変化を高感度に検出することが可能な技術です。
FTIR分光法で使用される従来の光源より100倍以上明るい、可変波長の量子カスケードレーザーが、マイクロ流体セルを通過してタンパク質溶液を探査します。
マイクロ流体セルでは、サンプルとリファレンス(バッファー)フローが急速に交互に切り替えられながら、サンプルとリファレンスの差分吸光度が各波長で測定され、連続的かつ自動的にバックグラウンドの減算が行われます。このことにより測定精度、正確性、シグナル・ノイズ比を劇的に改善し、高い再現性を実現します。
deltaソフトウェアは、Apolloで取得した高品質な差分吸収スペクトル(diffAU) データを迅速かつ容易に処理する強力な解析パッケージです。次のデータ解析ワークフローのようにタンパク質特性に関するデータを提供します。
※データは1mg/mL BSAの測定によるもの。
複雑な製剤バッファー中のモノクローナル抗体の解析
ウシ血清アルブミン (BSA) の熱変性の解析
ヒトIgG1への圧力と化学的環境の影響の解析
リガンドの結合と安定化によるタンパク質の構造変化の検出
市販のリファレンス・スタンダードのバイオシミラー構造⽐較
バイオシミラーの比較と加速安定性の予測
MMS解析後の回収サンプルの再測定
 ウシ血清アルブミン (BSA) の熱変性の解析 ウシ血清アルブミン (BSA) の熱変性の解析 |
異なる濃度(1mg/mL、20mg/mL、100mg/mL)のBSAサンプルは、25~90℃の温度範囲で20分間インキュベートし、MMS解析のために室温に冷却しました。タンパク質差分吸収スペクトルは4 cm-1ステップで約1700~1600cm-1のamide Iバンド全体で自動的に取得し、AQS3delta ソフトウェアを用いて解析しました。すべての測定は室温で行い、すべてのサンプルは希釈、透析または他のサンプル調製なしでネイティブ形状で測定しました。
高感度なMMS解析は、BSAの変性と凝集の発生を明確に示しました。
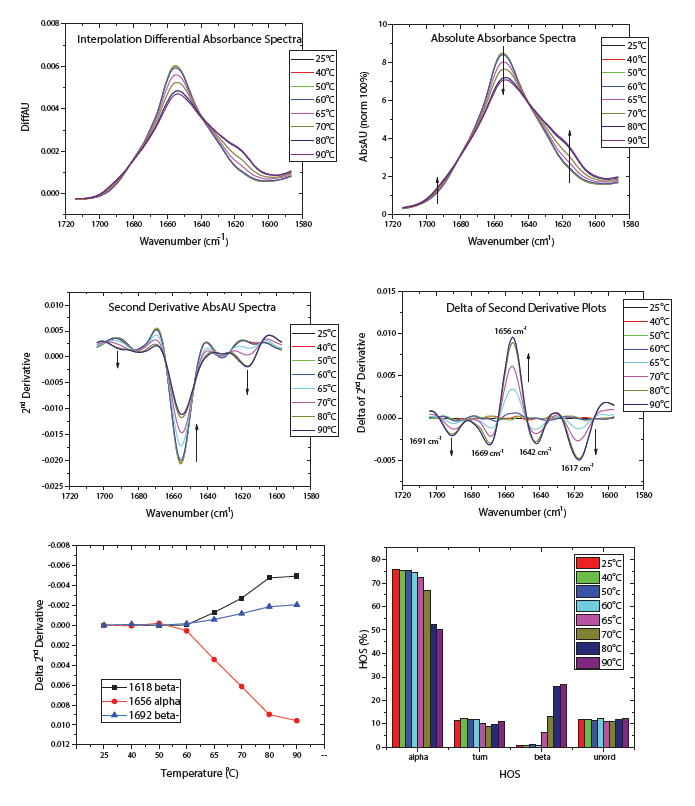
Figure 1:1mg/mLのBSA変性。温度が増加するに従って、αヘリックス構造(1656cm-1)の損失が観察された。これはタンパク質の変性を示す。また、β構造(1618と1692cm-1)の増加が観察され、これは凝集の発生を示す。これらの二次構造変化は60℃から始まり、80℃でプラトーに達するようであった。 20mg/mL、100mg/mLのサンプルにおいても1mg/mLで観察される結果と類似していたが、100mg/mLの70℃を上回る温度ではサンプルのゲル化が起こったため計測不能であった (data not shown)。
※RedShiftBio Application Note : 2019-01 “Thermal Denaturation Analysis of Bovine Serum Albumin over Wide Concentration Range by Microfluidic Modulation Spectroscopy” から引用
▲ アプリケーションの先頭へ戻る
|
 市販のリファレンス・スタンダードのバイオシミラー構造比較 市販のリファレンス・スタンダードのバイオシミラー構造比較 |
本研究では、ELISAベースのアッセイキットの社内標準として使用する製品候補を特定することを目的として、MMSにより、13種類の市販BSAサンプルを既知の活性を持つコントロールのリファレンス・スタンダード分子4112305と比較しました。
結果として、MMS測定の極めて⾼い感度と再現性により、<2%のサンプル間の構造的な違いを検出し、ELISA製品に組み込む際に許容できる活性を維持した5種類のBSAバイオシミラーサンプルを特定することに成功しました。
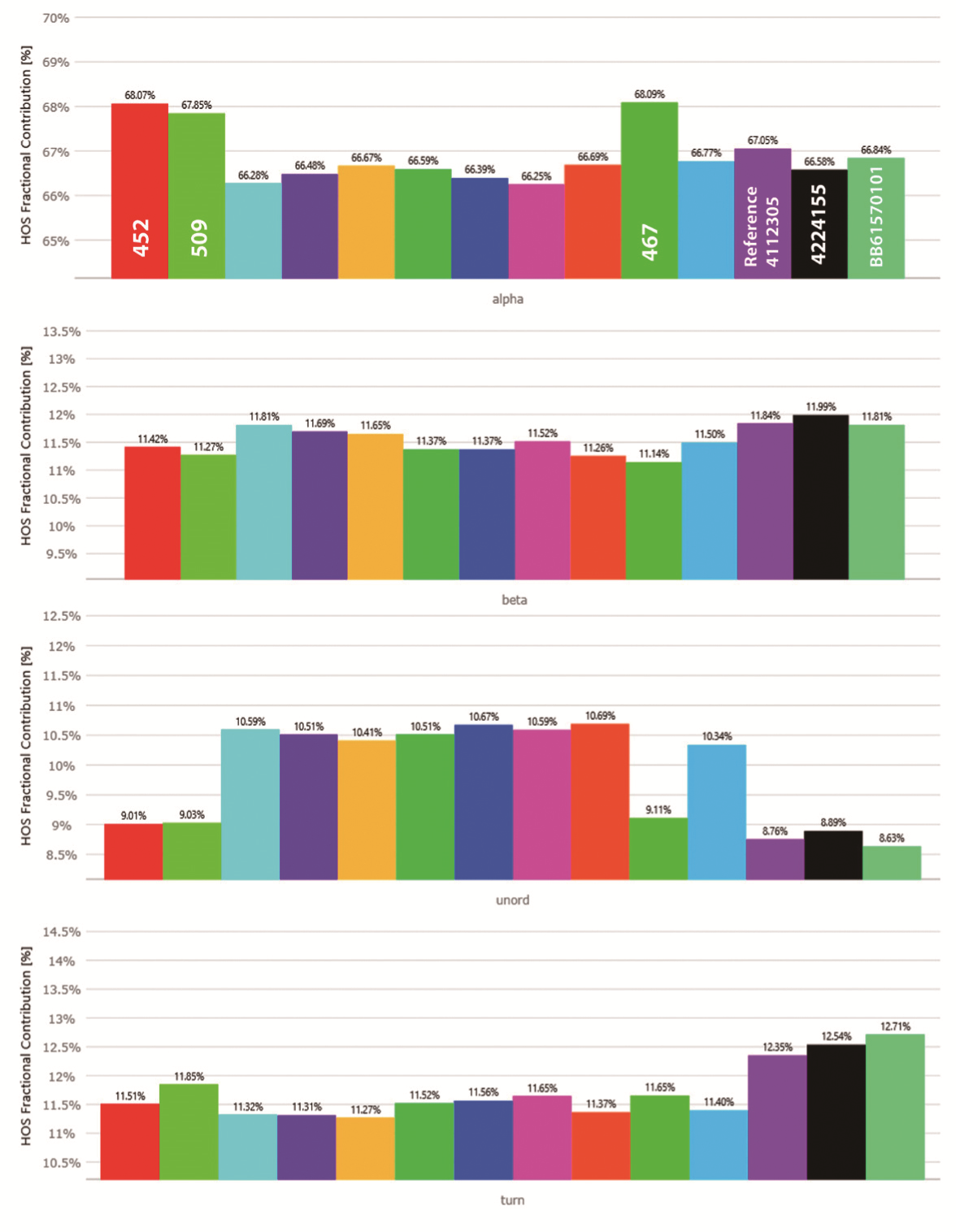
Figure:⾼次構造 (Higher Order Structure; HOS) プロットを、⼩さいながらも有意な差が強調されるようにスケーリングを調整したもの。
MMSによるデルタプロット解析、安定性プロット解析でコントロールと最も類似した構造を示した452、509、467、4224155、BB61570101は、ELISAベースのキットでも許容できる活性を示したが、その他の分子は示さなかった(data not shown)。
unordered構造の寄与がわずかであること、また最も高い程度のαヘリックス構造を⽰していることがELISA製品での最も⾼い活性と⼀致しており、αヘリックス領域がアッセイ活性に不可⽋である可能性を示した。
※RedShiftBio Application Note : "Biosimilar Structural Comparison of Commercially Sourced Reference Standards by MMS Rapidly Detects Subtle but Critical Differences to Correctly Predict Activity for Use in an ELISA Product" から引用
▲ アプリケーションの先頭へ戻る
|
 MMS解析後の回収サンプルの再測定 MMS解析後の回収サンプルの再測定 |
MMSは、⾼い再現性、⾼い感度、⾮破壊の⼆次構造特性評価技術であり、MMS解析後のサンプルを再回収して、さらなる特性解析に使⽤することが可能です。この事例では、HPLC⽔に5 mg/mLで調製したニワトリ卵⽩リゾチームをMMS解析し、解析後に回収したサンプルを、2つに分注して再測定しました。分注1は、さらなる処理なしでMMS解析を行い (collected)、分注2は、MMS再解析の前に 0.5 mL 10 kDa Pierce™濃縮機で濃縮し、その後MMS解析を行いました (concentrated)。卵白リゾチームの構造がMMS解析、再回収、再濃縮によって影響を受けず、貴重なサンプルを節約して再利⽤できることが実証されました。
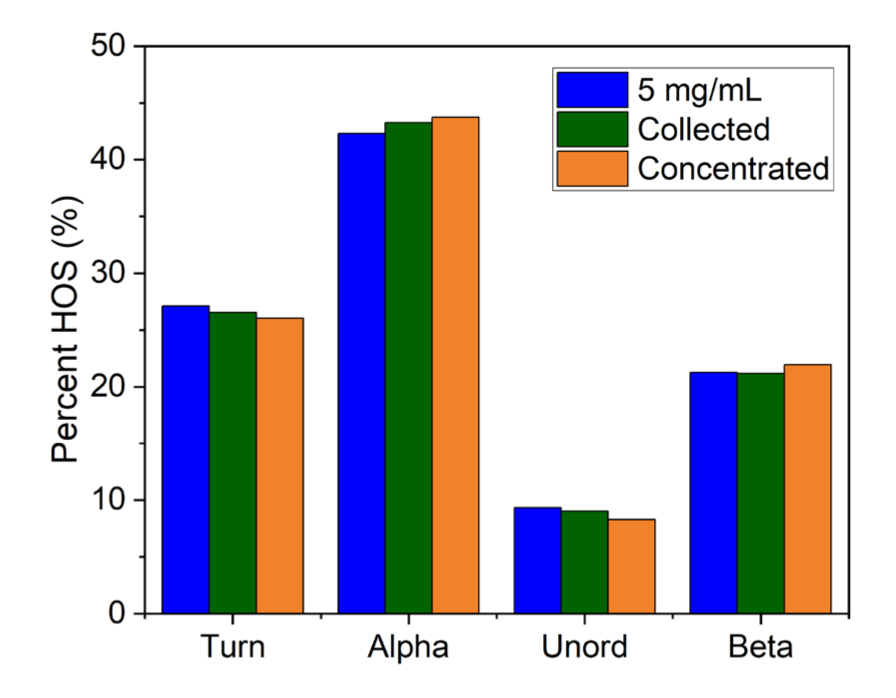
Figure:最初の 5mg/mL サンプル、再回収サンプル (Collected)、再濃縮サンプル(Concentrated) の⾼次構造 (HOS) の結果。各サンプルの⼆次構造要素の寄与率を⽰している。再回収および再濃縮の後も⼆次構造に⼤きな変化はなかった。
※RedShiftBio Application Note : "Microfluidic Modulation Spectroscopy as a Non-Destructive Structural Characterization Technique"から引用
▲ アプリケーションの先頭へ戻る
|

RedShiftBio社 次世代タンパク質特性評価システム関連アプリケーション資料の日本語版を以下ページからダウンロードいただけます。各記事からご利用ください。
RedShiftBio:アプリケーション資料日本語版一覧ページ
RedShiftBio社 次世代タンパク質特性評価システム関連アプリケーション資料の日本語版を、下記ページよりダウンロードいただけます。各記事からご利用ください。
RedShiftBio:アプリケーション資料日本語版一覧ページ
Pharmaceutical Outsourcingで取り上げられた
Fina Biosolutions社の事例です。同社は、AQS3pro MMSプラットフォームをワークフローに組み込んで、新しく改良されたキャリアタンパク質を開発しました。
 中分子/高分子医薬品における新規特性解析ツールの活用事例
中分子/高分子医薬品における新規特性解析ツールの活用事例 (ライブ実施日時:2024-03-07)


近年、抗体医薬品に代表されるバイオ医薬品や核酸医薬品の開発が盛んにおこなわれています。
さらに、新たな創薬モダリティとして遺伝子治療やmRNA医薬品の上市が進められております。
新医薬品開発においては分子の特性を明らかにすることの重要度が高く、生物学的な活性以外に物理化学的な特性解析を行う必要があります。
中でも高次構造は活性との相関性が高く、安定性の予測においても役立つパラメータです。
分光学的手法によるスペクトル解析から、バイオ医薬品をはじめとした近年注目を浴びている創薬モダリティにおいて、Similarity(同質性)、Aggregation(凝集)、Quantitation(定量)、Structure(構造)、Stability(安定性)の評価を可能にする画期的な構造解析技術、MMS法(Microfluidic Modulation Spectroscopy)をADCやRNAの測定事例を交えてご紹介いたします。
※上記画像をクリックいただくと、別タブでお名前等をご入力する欄が表示されます。ご入力の上視聴ください。
 タンパク質の特性解析における強力な新規ツールとその活用事例のご紹介
タンパク質の特性解析における強力な新規ツールとその活用事例のご紹介 (ライブ実施日時:2022-11-17)

バイオ医薬品開発においてタンパク質の特性解析は必要不可欠であり、様々なツールが用いられています。RedShiftBio社製AQS3pro及びApolloは分光学的手法によるタンパク質の特性解析により、創薬から製造までのすべての開発フェーズをサポートする新規ツールです。
これまでの分光学的手法を用いたタンパク質の特性評価ツールではバッファー環境や水の影響がクリティカルであり、克服すべき課題でした。本ツールはその課題を克服し、高解像度かつ自動化された解析方法によりラベルフリーで安定性、同質性といったタンパク質の特徴を捉えることが可能です。
本ウェビナーではこの新規ツールの測定原理や最近報告された免疫グロブリンアミロイドーシスの特性解析やインスリンのバイオシミラー評価を含む活用事例をご紹介いたします。
※上記画像をクリックいただくと、別タブでお名前等をご入力する欄が表示されます。ご入力の上視聴ください。
 タンパク質の特性解析における強力な新規ツールのご紹介
タンパク質の特性解析における強力な新規ツールのご紹介 (ライブ実施日時:2022-07-28)

RedShiftBio社製AQS3pro及びApolloは分光学的手法によるタンパク質の特性解析により、創薬から製造までの
すべての開発フェーズをサポートする新規ツールです。
これまでの分光学的手法を用いたタンパク質の特性評価ツールではバッファー環境や水の影響がクリティカルであり、
克服すべき課題でした。本ツールはその課題を克服し、高解像度かつ自動化された解析方法によりラベルフリーで
安定性、同質性といったタンパク質の特徴を捉えることが可能です。
本ウェビナーではRedShiftBio社独自の新規技術にフォーカスし、アプリケーション事例や2機種(AQS3pro及びApollo)
の違いを交えてご紹介いたします。
※上記画像をクリックいただくと、別タブでお名前等をご入力する欄が表示されます。ご入力の上視聴ください。
 バイオ医薬品開発における分光学的手法を用いたタンパク質の特性評価事例のご紹介
バイオ医薬品開発における分光学的手法を用いたタンパク質の特性評価事例のご紹介 (ライブ実施日時:2021/7/7)

RedShiftBio社製 次世代タンパク質特性評価システム AQS
3®proは、新規の分光学的手法であるマイクロ流体変調分光法(Microfluidic Modulation Spectroscopy; MMS)を用いたタンパク質・ペプチドの二次構造解析システムです。従来のタンパク質二次構造解析技術を大幅に上回るダイナミックレンジ、感度、精度を提供しながら、自動化された解析方法で、タンパク質の二次構造、類似性、安定性、凝集、定量に関する測定をラベルフリーで行うことができます。二次構造という、基礎的な構造情報を取得することにより、創薬・製剤・製造まで、すべての開発フェーズにおけるバイオ医薬品の特性評価をサポートします。
本セミナーでは、MMS技術や抗体薬物複合体(Antibody Drug Conjugate; ADC)をはじめとした バイオ医薬品に関連した測定事例についてご紹介いたします。
※上記画像をクリックいただくと、別タブでお名前等をご入力する欄が表示されます。ご入力の上視聴ください。