少量のサンプルでタンパク質の特性を高感度に評価
RedShiftBio社製 次世代タンパク質特性評価システム Aurora TX は、マイクロ流体変調分光法(Microfluidic Modulation Spectroscopy; MMS)を用いた、コンパクトなサイズのタンパク質・ペプチド特性評価システムです。
従来のタンパク質二次構造解析技術を大幅に上回るダイナミックレンジ、感度、精度を提供しながら、タンパク質の二次構造、類似性、安定性、凝集、定量に関する測定・解析をラベルフリー・自動で行うことができます。
RNA評価にも適した測定スペクトル範囲とThermal ramping機能も搭載し、より幅広いアプリケーションにお使いいただけます。
創薬・製剤・製造まで、すべての開発フェーズにおけるバイオ医薬品の特性評価をサポートします。
特長
- 二次構造、 類似性、化学的および熱安定性、凝集、定量の高感度解析
※従来のFTIR分光法と比較して、感度を30X改善
- Thermal ramping 機能
安定性・凝集に関するより深い知見が得られる
- RNA 評価にも適した測定スペクトル範囲
- 広い解析濃度範囲 (定量:0.1 ~ 100 mg/mL、構造解析:0.5 ~ 100 mg/mL) により、
サンプルの希釈または濃縮不要
- わずか50μL のサンプル量 (Tripricate) で再現性の高いデータを取得
※Thermal ramping 測定時を除く
- 計測時間~18分 (Tripricate)
※Thermal ramping 測定時を除く
- 外付けバッファーステーション
最大8種類のバッファーをシステムに直接統合することによりスループットを向上。
- ラベルフリー解析
- 汎用96ウェルプレートでの解析が可能
- サンプル解析からデータ処理までを完全に自動化
- タッチスクリーン一体型のコンパクトなシステム
ページの先頭に戻る
マイクロ流体変調分光法 (Microfluidic Modulation Spectroscopy; MMS)の原理
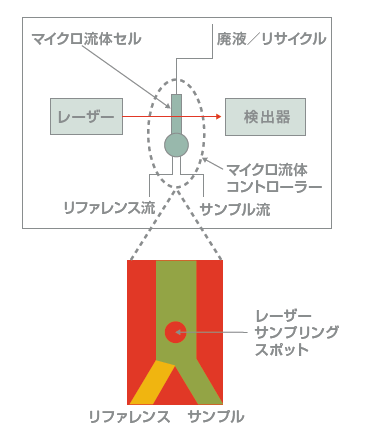
中赤外レーザーを用いて AmideIバンド(1590~1765cm
-1)における差分吸光度を測定し、タンパク質二次構造の変化を高感度に検出することが可能な技術です。
FTIR分光法で使用される従来の光源より100倍以上明るい、可変波長の量子カスケードレーザーが、マイクロ流体セルを通過してタンパク質溶液を探査します。
マイクロ流体セルでは、サンプルとリファレンス(バッファー)フローが急速に交互に切り替えられながら、サンプルとリファレンスの差分吸光度が各波長で測定され、連続的かつ自動的にバックグラウンドの減算が行われます。このことにより測定精度、正確性、シグナル・ノイズ比を劇的に改善し、高い再現性を実現します。
ページの先頭に戻る
deltaソフトウェア
deltaは、Aurora TXで取得した高品質な差分吸収スペクトル(diffAU) データを迅速かつ容易に処理する強力な解析パッケージです。次のデータ解析ワークフローのようにタンパク質特性に関するデータを提供します。
※データは1mg/mL BSAの測定によるもの。
ページの先頭に戻る
アプリケーション
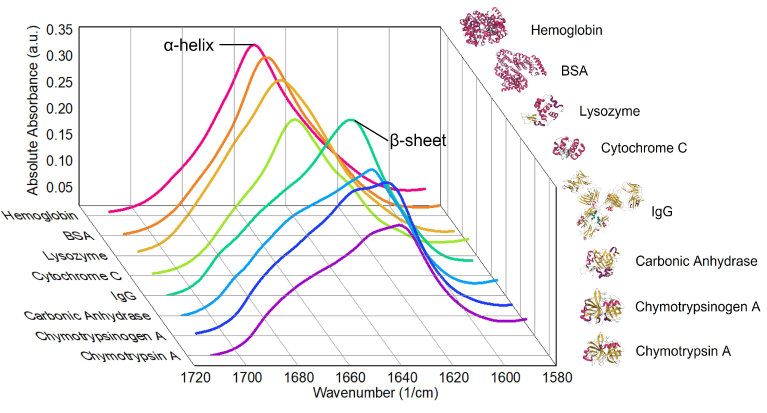
タンパク質、ペプチド、抗体、ADC (抗体-薬物複合体) 、RNAなどの特性評価
- バッファー/pH/処方、ストレス、点変異、結合パートナー、保存条件等による構造変化を測定可能。
- 測定前にバッファー交換や希釈を行う必要がなく、実験・治療に関連した条件下で測定可能。
アプリケーション事例
従来モデル Apollo での事例はこちらからご覧いただけます。
 GLP-1類似体および製剤の構造解析 GLP-1類似体および製剤の構造解析 |
|
グルカゴン様ペプチド-1(GLP-1)類似体は、グルコース依存性のインスリン分泌を促進し、満腹感を促進し、体重減少をサポートすることにより、重要な治療効果をもたらします。セマグルチド(Mounjaro®、Ozempic®、Rybelsus®、Wegovy®の有効成分)やリラグルチド(Victoza®、Saxenda®の有効成分)などの合成GLP-1受容体作動薬は、ネイティブのGLP-1に比べて安定性、半減期、有効性が向上するように設計されており、代謝疾患管理における重要な治療薬となっています。MMSは、未修飾GLP-1と市販のGLP-1類似体の濃度と二次構造を様々なバッファーと濃度の組み合わせにおいて測定し、構造的差異を特定することができます。
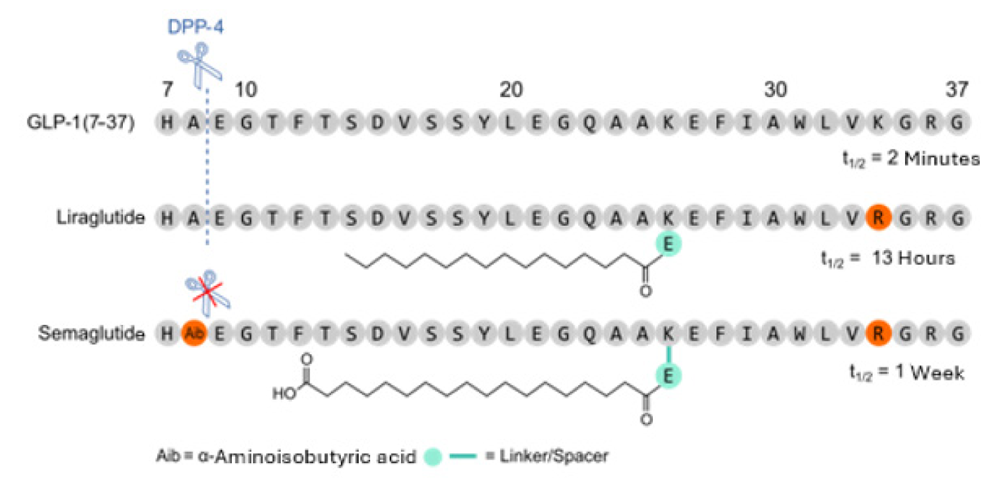
Figure 1:GLP-1 (7-37)、リラグルチド、セマグルチドの一次配列。すべての化学修飾と半減期(t1/2)も示す。
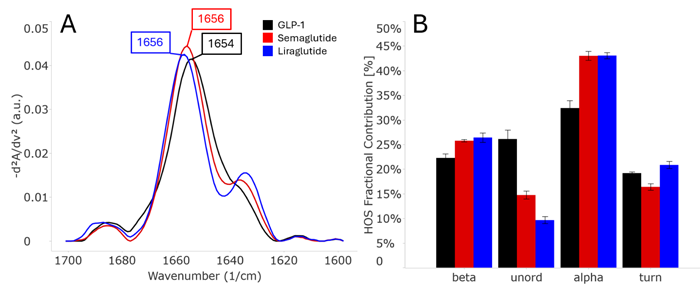
Figure 2:PBSに溶解した2 mg/mL濃度のGLP-1(7-37)、セマグルチド、リラグルチドの二次構造を比較したもの。(A) 類似性プロットは、これらのペプチド間には明確なスペクトルの違いがあり、それらの違いは1656cm-1付近の主要なピークと1640cm-1付近の領域に見られることを示す。(B)HOS棒グラフから明らかであるように、3つのペプチドとも特にαへリックスとunordered構造における大きな構造変化がみられる。
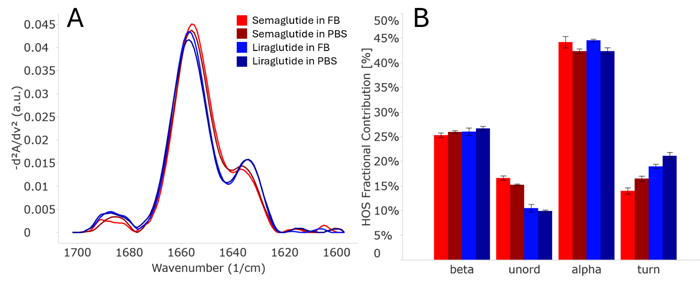
Figure 3:PBSと製剤バッファー(FB)中のセマグルチドとリラグルチドの二次構造の比較。(A)類似性プロットは、各製剤中のリラグルチドとセマグルチドの両方が類似していることを示しているが、1640cm-1領域にわずかな違いが見られる。スペクトルの変化を高次構造へと定量化すると(B)、製剤バッファー(FB)からのバッファー交換による明らかな変化が見られる。各ペプチドは、製剤バッファー中ではαヘリックス構造がより多くなり、ターン構造はより少なくなっている。これはおそらく、より高いネイティブ構造による安定性の増加を示している。
RedShiftBio Application Note AN-850-0147 “Structural Characterization of GLP-1 Analogues and Formulations Using Microfluidic Modulation Spectroscopy” より引用
|
▲ アプリケーションの先頭へ戻る
 様々なpH および濃度のタンパク質ライブラリーの構造の評価と温度ストレスの⽐較 様々なpH および濃度のタンパク質ライブラリーの構造の評価と温度ストレスの⽐較 |
|
バイオ医薬品の融解温度(Tm) は、特に機能性、製造性、製剤の安定性を明らかにするものであるため、特性評価において極めて重要です。さらにTm は、標的タンパク質や標的RNAに対する低分⼦医薬品候補の安定化効果を報告することができる汎⽤性の⾼いパラメーターです。Tm は、分⼦の半分がアンフォールディングし、半分がフォールディングする温度であるため、Tmが⾼いほど⾼分⼦は安定です。従来、Tm を測定する装置はTm のみ提供し、構造に関する他の情報や⽂脈を提供しませんでした。しかしながら、Aurora TXにより、MMS を⽤いてTm を測定することが可能になり、ランプに沿った各温度における完全な⼆次構造情報が得られます。このことにより、どの構造成分が変化しているかを観察し、2D ヒートマップを⽤いてバイオ医薬品の異なる部分の安定性に対する異なる薬物や構造の影響を調べることができます。
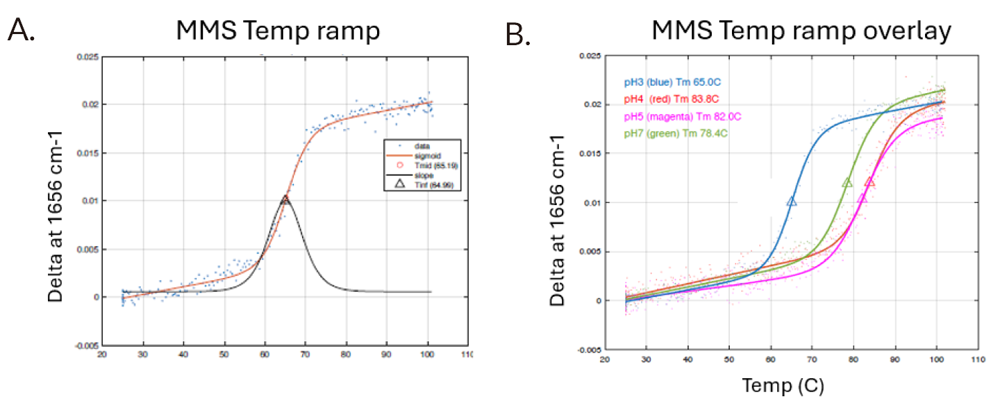
Figure 1.(A)pH 3における2mg/mL リゾチームの融解曲線。一次微分プロットはTm を示す。αヘリックス構造の量に対応する1656 cm-1 のシグナルのみに注⽬している。(B)pH3、4、5、7における融解曲線のオーバーレイ。pH4のサンプルのTm が最も⾼く、これが最も安定な製剤pHであることを⽰している。
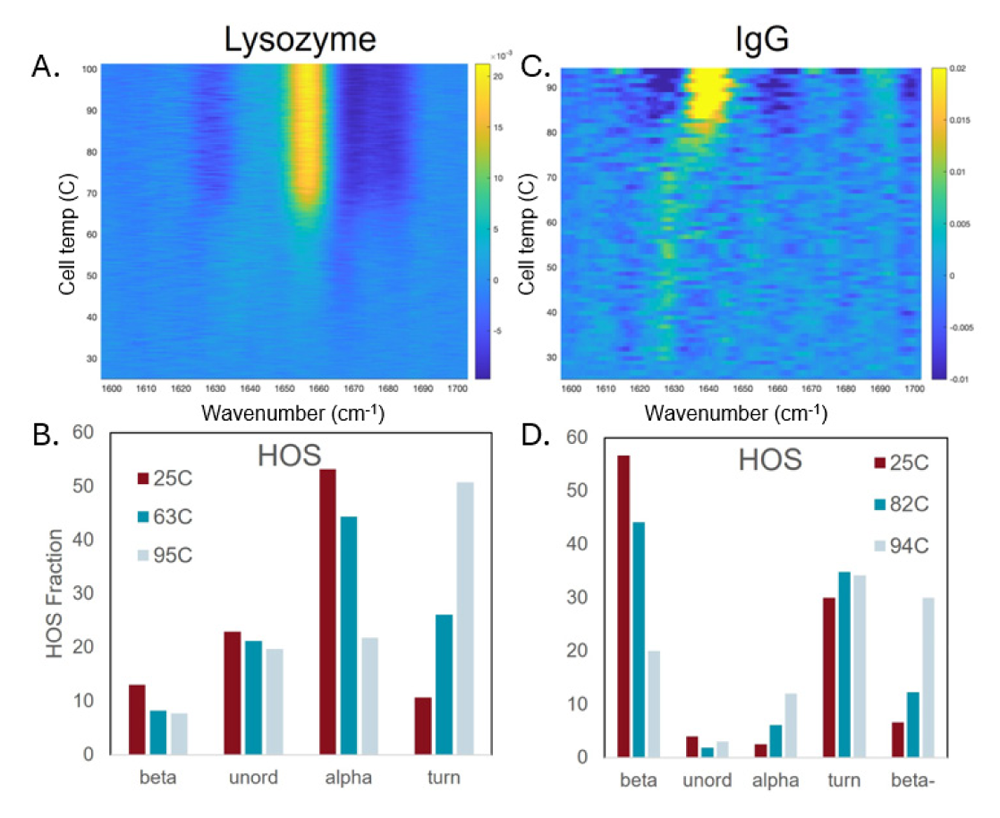
Figure 2.(A)反転ヒートマップとしてのMMS熱融解プロット。y軸は温度、x軸は波数で、⻩⾊の領域は構造の減少を、濃⻘⾊は構造の増加を⽰している。(B)リゾチームの高次構造(HOS)棒グラフ。温度によるαヘリックスの減少とターン構造の増加を示す。(C)IgG の2D MMS 融解プロット。IgG のアンフォールディングはリゾチームに⽐べてはるかに⾼い温度で起こることを示している。(D)IgG で観察された構造の変化。特に平行βシート(beta)の減少と逆平行β(beta-)の増加を認めた。
RedShiftBio Application Note AN-850-0144 “Structural Characterization and Comparison of Temperature Stress on a Protein Library Across pH and Concentration using Microfluidic Modulation Spectroscopy“ より引用
|
▲ アプリケーションの先頭へ戻る
 脂質付加RNAの測定 脂質付加RNAの測定 |
|
治療用mRNA薬剤は、mRNAを転写可能な適切な臓器に送達するため、脂質ナノ粒子(LNP)に製剤化されます。しかしながら、イオン化可能な脂質によって核酸塩基が修飾され、mRNAの活性と安定性を低下させることが観察されています。この修飾には、イオン化可能な脂質が核酸塩基と共有結合することが関与しており、その結果、結合しているRNA分子に脂質付加物が生じます。この研究では、pH7とpH5のpolyC(i-motif)をRNAとして、SM-102を脂質として用いました。
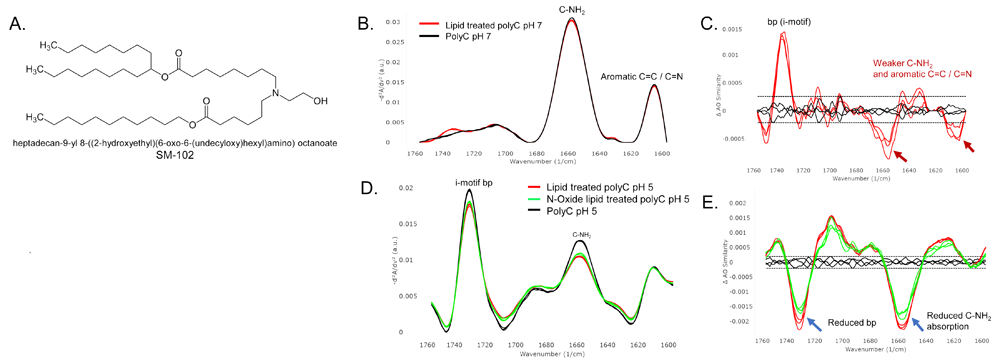
Figure:(A)SM-102脂質の構造。(B)pH7におけるpolyCと脂質処理polyCのMMSスペクトル。(C)pH7におけるpolyCと処理polyCの微妙な違いを強調するMMSデルタプロット。(D)i-motif形成を促進するpH5におけるpolyCと処理polyC。(E)pH5におけるpolyCと処理polyCのMMSデルタプロットは、脂質処理サンプルの塩基対形成の消失を示す。
|
▲ アプリケーションの先頭へ戻る
 RNA構造の特性評価とRNA-リガンド結合の検出 RNA構造の特性評価とRNA-リガンド結合の検出 |
|
リボスイッチは、タンパク質産⽣を制御するために特定のmRNA セグメントの翻訳を制御する、⼩さく折りたたまれたmRNA 配列です。それぞれのリボスイッチは、結合時に構造変化を引き起こしリボスイッチの活性化をもたらす、ユニークな低分⼦を含んでいます。S-アデノシルメチオニン(SAM)-I リボスイッチは、多くの細胞プロセスに関与する重要な代謝産物であり、細胞内のSAM 濃度の変動に応答して遺伝⼦発現を制御します。
本研究では、⽂献から得られたX 線結晶構造解析データとMMS を⽤いて、リガンド結合に伴うSAM-I リボスイッチの構造変化を明らかにし、⾒かけの解離定数Kd を決定しました。MMS により、結合親和性だけでなく、結合に伴う構造変化についての総合的な理解を深め、治療⽬的のRNA の新規低分⼦制御因⼦の開発に役⽴てることができます。
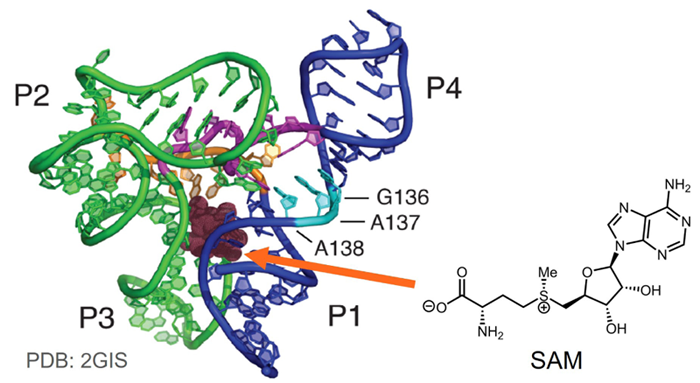
Figure 1. リガンドが結合したSAM-I リボスイッチのX線結晶構造 (PDB: 2GIS) とSAM の化学構造。
Copyright 2017 by RNA Society.
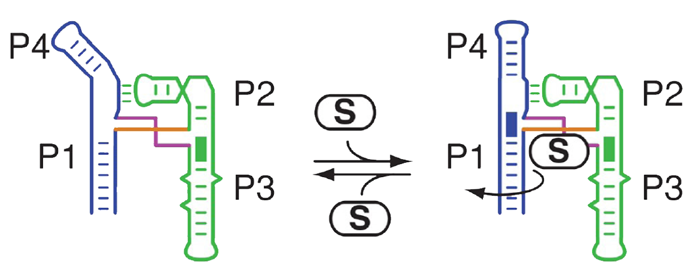
Figure 2. SAMの結合によりSAM-I リボスイッチに構造変化が起こる。Four-way junction にSAM が結合すると、P1 ドメインはリガンドに結合するために回転し、次にP4 ドメインに⼤きなアロステリック変化を引き起こす。Dussault, A.-M. et al., RNA. 2017 Oct;23(10):1539-1551より引⽤。Copyright 2017 by RNA。
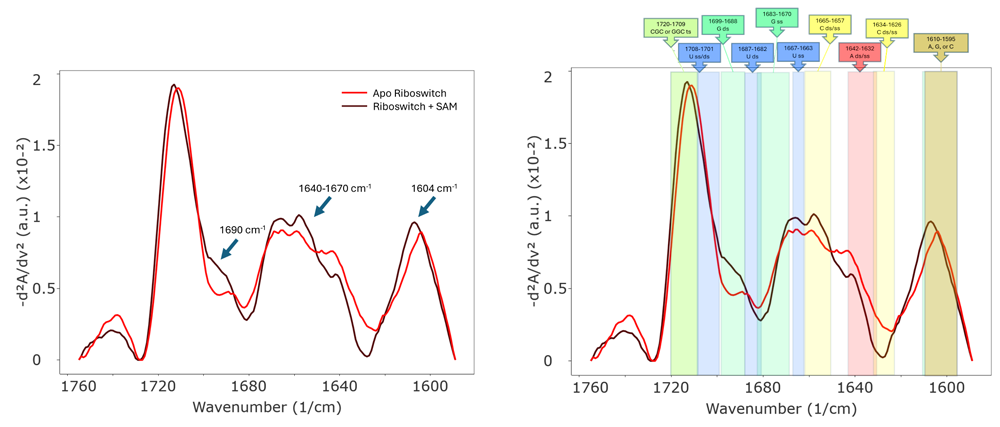
Figure 3. (左) アポ型リボスイッチとリガンド結合型リボスイッチのMMSスペクトル(類似性プロット)。 (右) アポ型リボスイッチとリガンド結合型リボスイッチのMMSスペクトル(類似性プロット)とピークの割り当て (ss: ⼀本鎖、ds: ⼆本鎖、ts: 三本鎖)。1690、1640-1670、1604 cm-1の領域のピークに変化があり、これらはそれぞれ主にグアニン、ウラシル/シトシン、アデニンに割り当てられる。特に、1690 cm-1 における強度の増加は、⼆本鎖または塩基対状態におけるグアニンC=O 伸張を⽰している。リガンドが結合したSAM-I リボスイッチの結晶構造(PDB: 2GIS) から、この結合がリボスイッチのU57、A45、A46、G11、G58 とSAM の相互作⽤を伴ったものであることが⽰された。
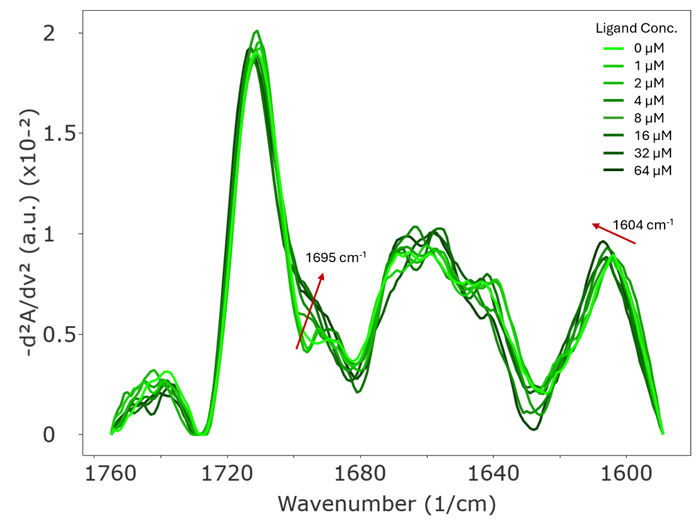 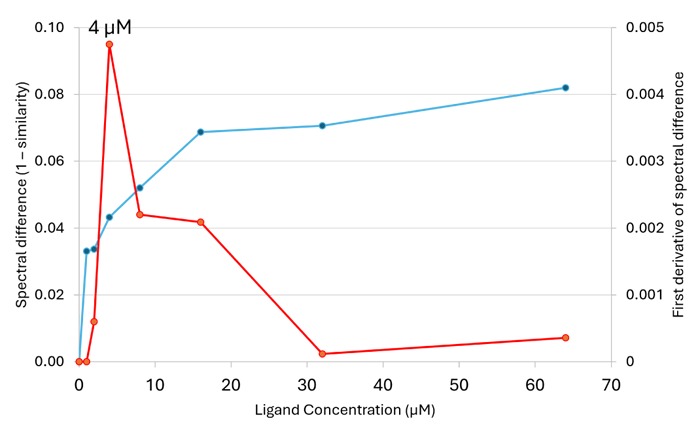
Figure 4. (左) SAM-I リボスイッチ (濃度0.67mg/mL (22 μM)) へのSAM の⽤量依存的滴定。SAM 濃度が⾼くなるにつれて、スペクトルが徐々に変化していることが観察された。1695 cm-1 における増加は、Figure 3 に⽰されたグアニン塩基対形成を⽰唆している。1604 cm-1 から1607 cm-1 へのシフトは、2 つのアデニン(A45、A46) とSAM との相互作⽤によるものと考えられる。(右) SAM 滴定に対するarea of overlap (AO) のスペクトル変化。Apo 型リボスイッチをリファレンスとして⽤いた。SAM 濃度が⾼くなるにつれてスペクトル変化は⼤きくなる。スペクトル変化(⻘) は、〜20μM 以降、すなわち、リガンドとリボスイッチのモル⽐が1:1 程度であるSAM 濃度でプラトー化し、本研究で観察されたスペクトル変化が、実際にリガンド結合によるものであることを⽰す。スペクトル差の1 次微分(⾚) は、スペクトル変化が最も速く起こるSAM 濃度が4μM であることを強調する。
RedShiftBio Application Note AN-850-0142 “Structural Characterization of RNA and Detection of RNA-ligand Binding Using Microfluidic Modulation Spectroscopy” より引用
|
▲ アプリケーションの先頭へ戻る
 RedShiftBio社 次世代タンパク質特性評価システム関連アプリケーション資料の日本語版を以下ページからダウンロードいただけます。各記事からご利用ください。
RedShiftBio社 次世代タンパク質特性評価システム関連アプリケーション資料の日本語版を以下ページからダウンロードいただけます。各記事からご利用ください。
RedShiftBio:アプリケーション資料日本語版一覧ページ
ページの先頭に戻る
アプリケーション資料日本語版ダウンロードページ 
RedShiftBio社 次世代タンパク質特性評価システム関連アプリケーション資料の日本語版を、下記ページよりダウンロードいただけます。各記事からご利用ください。
RedShiftBio:アプリケーション資料日本語版一覧ページ
ページの先頭に戻る
オンデマンドWebinar (弊社実施|日本語)
 中分子/高分子医薬品における新規特性解析ツールの活用事例
中分子/高分子医薬品における新規特性解析ツールの活用事例 (ライブ実施日時:2024-03-07)


近年、抗体医薬品に代表されるバイオ医薬品や核酸医薬品の開発が盛んにおこなわれています。
さらに、新たな創薬モダリティとして遺伝子治療やmRNA医薬品の上市が進められております。
新医薬品開発においては分子の特性を明らかにすることの重要度が高く、生物学的な活性以外に物理化学的な特性解析を行う必要があります。
中でも高次構造は活性との相関性が高く、安定性の予測においても役立つパラメータです。
分光学的手法によるスペクトル解析から、バイオ医薬品をはじめとした近年注目を浴びている創薬モダリティにおいて、Similarity(同質性)、Aggregation(凝集)、Quantitation(定量)、Structure(構造)、Stability(安定性)の評価を可能にする画期的な構造解析技術、MMS法(Microfluidic Modulation Spectroscopy)をADCやRNAの測定事例を交えてご紹介いたします。
※上記画像をクリックいただくと、別タブでお名前等をご入力する欄が表示されます。ご入力の上視聴ください。
ページの先頭に戻る
ソフトウェア・交換部品・消耗品
| 型式 |
詳細 |
| RSB500-511 |
Aurora-delta オフラインソフトウェア (追加ライセンス) |
| RSB500-556 |
Aurora TX Thermal Ramp フローセル |
| RSB500-541 |
Aurora フローセル・アセンブリ |
| RSB500-542 |
Aurora フローセル・アセンブリ (下取り交換) |
| RSB500-543 |
Aurora 96ウェルプレート・プレート シール (50セット) |
| RSB500-544 |
Aurora 96ウェルプレート (50個) |
| RSB500-545 |
Aurora プレートシール (50枚) |
ページの先頭に戻る
仕様
ページの先頭に戻る
References 
 Biochemical and Structural Analyses of the Tardigrade DNA-Damage Suppressor Protein, Dsup
Biochemical and Structural Analyses of the Tardigrade DNA-Damage Suppressor Protein, Dsup
Tyler J. Woodward and M. Todd Washington. J Mol Biol. 2025 Oct 20;437(24):169490. doi: 10.1016/j.jmb.2025.169490. ( )
)
 Application of microfluidic modulation spectroscopy for simultaneous structural and thermal stability analysis of commercial mAbs under varying formulation conditions
Application of microfluidic modulation spectroscopy for simultaneous structural and thermal stability analysis of commercial mAbs under varying formulation conditions
Yalan Yang et al., Anal Methods. 2025 May 15;17(19):4087-4093. doi: 10.1039/d4ay02324b. ( )
)
Sensing Protein Structural Transitions with Microfluidic Modulation Infrared Spectroscopy
Lathan Lucas et al.,Biosensors. 2025 Jun 13;15(6):382. doi: 10.3390/bios15060382. ( )
)
Structural proteomics defines a sequential priming mechanism for the progesterone receptor
Matthew D. Mann et al., Nat Commun. 2025 May 12;16(1):4403. doi: 10.1038/s41467-025-59458-y. ( )
)
Stability convergence in natural antibodies with ultra-long hypervariable loops
Marcel Passon et al., Commun Biol. 2025 Apr 19;8(1):635. doi: 10.1038/s42003-025-08036-5.( )
)
Real-time monitoring of higher-order structure of RNAs by temperature-course size exclusion chromatography and microfluidic modulation spectroscopy
Bingchuan Wei et al., Anal Chem. 2025 Mar 18;97(10):5632-5642. doi: 10.1021/acs.analchem.4c06343.( )
)
※上記の他にも従来モデルAQS
3proおよびApolloを用いた論文が多数ございます。
論文リストは
こちらからご覧いただけます。
ページの先頭に戻る