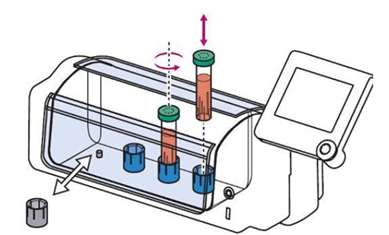
CERO 3Dベンチトップインキュベーター・バイオリアクターは、温度・CO
2レベルをコントロール、pHをモニタリング可能な装置と、専用のCEROTubeを組み合わせることで、3D細胞培養に最適な環境を作り出します。
CEROTubeは、最大50mlの容積で、小さなフィンと平らな底を持ち、細胞へのせん断ストレスを軽減し、穏やかな培養条件を可能にします。1~4個のCEROTubeを個別に制御し、最小限のハンドリング時間(1日4分程度)で、標準化された再現性ある方法で最大のバイオマス収量を提供します。

多能性幹細胞
肝炎ウイルス研究モデル:スフェロイド
心筋組織モデル
腫瘍組織モデル:オルガノイド
個別化医療と精密医療
 多能性幹細胞 多能性幹細胞 |
CERO 3D(旧名 "BioLevitator")で拡大培養されたヒトiPS細胞は、多能性を維持し、三胚葉すべてに分化することができます。
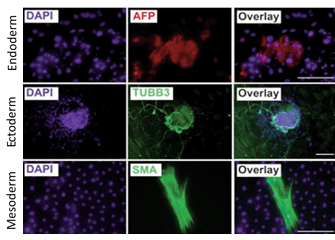
Elanzev et. al. 2015; Biotechnol. J. 2015, 10, 1589–1599
▲ アプリケーションの先頭へ戻る
 肝炎ウイルス研究モデル:スフェロイド 肝炎ウイルス研究モデル:スフェロイド |
3D 環境に保たれた細胞は、従来の2D単層培養よりも効率的に組織様構造を模倣する能力を持っており、長期的な3D細胞培養は、疾患モデリングや創薬において大きな可能性を秘めています。しかしながら、スフェロイドを長期培養する際、多くの科学者は多くの技術的制限に悩まされてきました。
CERO 3Dは、科学者がこれまでできなかった実験を可能にする画期的な技術です。
CERO 3Dで80日間以上培養したHepG2細胞(肝細胞株)のスフェロイド。(左)細胞は、細胞増殖マーカーKI67陽性である。(中)細胞は、アポトーシスマーカー Casp.cl.3陰性である。(右)細胞は、アルブミン陽性である。
▲ アプリケーションの先頭へ戻る
 心筋組織モデル 心筋組織モデル |
幹細胞由来の心筋細胞は、心血管研究、疾患モデリングおよび薬剤開発の分野でますます注目を集めています。
CERO 3Dは、幹細胞を均質な凝集塊で拡張させた後、多数の拍動心筋体に直接誘導するというワークフローを可能にします。CERO 3Dでの多能性幹細胞の拡張とそれに続く心筋誘導/分化は、従来のオービタルシェーカーに比べ、細胞の質、均質性、完全性、収量がはるかに高くなります。
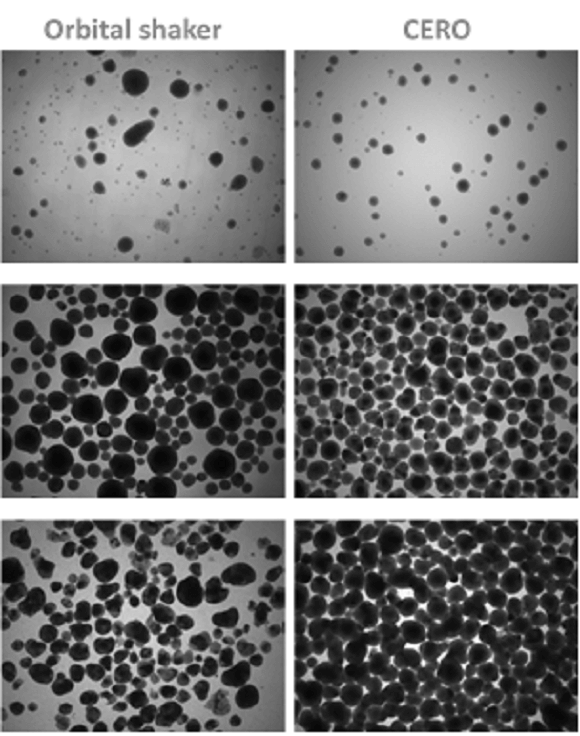
CERO 3Dとオービタルシェーカーの比較。心筋誘導の3、8、13日後のマウス胚性幹細胞由来心筋細胞の分化。
▲ アプリケーションの先頭へ戻る
 腫瘍組織モデル:オルガノイド 腫瘍組織モデル:オルガノイド |
CERO 3Dは、多能性幹細胞や成体幹細胞からオルガノイドを作製するための画期的な技術です。がん研究のツールとして使用される均質なオルガノイドを、効率的かつ標準化可能な方法で生成し、高い収率で維持することができます。驚くべきことに、このオルガノイドはin vivoでの反応を予測する能力も持っています。
(左)7日目と22日目の胃オルガノイド(明視野)。小さな嚢胞から大きな球形に拡大する。(右)胃オルガノイドのHE染色(2a)は、PCRの結果(2b)に見られるように、胃に見られるさまざまな細胞タイプからなる上皮細胞の単層を示す。胃ムチンMUC5ACやMUC6、トレフォイル因子、ペプシノーゲンなどが発現している。Lgr5やSox2のような幹細胞マーカーも存在している。
▲ アプリケーションの先頭へ戻る
 個別化医療と精密医療 個別化医療と精密医療 |
CERO 3Dは、患者由来の原発性腫瘍細胞を増殖、維持し、妥当な3D in vitroモデルを構築することによって、精密医療を加速します。
(左)CK20陽性胆管細胞がん細胞 (中)HE染色:生きた胆管細胞がん細胞 (右)MAPAC 155 陽性細胞
▲ アプリケーションの先頭へ戻る
タイトル『New Approach Methodologies (NAMs)に貢献する3D細胞培養インキュベーター』

※上記画像をクリックすると、視聴画面に遷移します。お名前等をご入力の上ご覧ください。
【要旨】
医薬品開発において、より安全で有効な薬剤を迅速に提供するため、ヒトでの予測性の高い評価法、すなわちNew Approach Methodologies(NAMs)の導入が国際的に重要視されています。NAMsは動物実験代替法の観点から、in vitro、in silico、臓器チップ(Organ-on-chip, MPS)など最先端の科学技術や手法を含み、医薬品開発の効率向上と迅速化を促進すると期待されています。
OMNI Life Science社が提供するベンチトップインキュベーター・バイオリアクターCERO 3Dは、このNAMsの進展に大きく寄与する革新的な3D細胞培養システムです。その最大の特徴は、マトリゲル基底膜などの支持層を不要としつつ、ヒトiPS細胞(hiPSC)や間葉系幹細胞(MSC)の3D培養下での増殖率を従来の6ウェルプレートと比較して3.5〜8倍に向上させ、同時に多能性を維持する点です。これにより、100万細胞あたりのコストを最大75%削減し、手作業時間を最大83%削減可能となり、研究の生産性とコスト効率を飛躍的に高めます。
CERO 3Dは、独自の低いせん断力で均一な培養を可能にする回転培養システムを備え、肝臓、神経、心臓、腎臓、網膜、がんなど多様なスフェロイド・オルガノイドの培養効率を劇的に改善します。均一なスフェロイド・オルガノイドを数ヶ月以上にわたり安定して長期培養できるため、生理学的関連性の高いin vitroモデル作製を可能にし、より正確なヒト有害事象予測、ひいては安全性薬理評価や毒性評価の予測性向上に貢献します。
本ウェビナーでは、CERO 3Dがどのように次世代の医薬品評価と研究開発プロセスのブレークスルーを支援するかを詳細に解説します。
[ライブ実施:2025/8/27]

Wolfram, A. & Arnold, V. et al., 3R-Compliant Murine Ex Vivo Platform for Scalable Brain Cancer Modeling and Drug Screening.
bioRxiv 2025.03.03.641148. DOI: https://doi.org/10.1101/2025.03.03.641148 (

)
Kot K. et al., The effect of human PBMCs immobilization on their Аβ42 aggregates-dependent proinflammatory state on a cellular model of Alzheimer’s disease.
Front. Neurosci. 2024. DOI: 10.3389/fnins.2024.1325287 (

)
M. Abdin et. al., Scalable generation of functional human iPSC-derived CAR-macrophages that efficiently eradicate CD19-positive leukemia.
J Immunother Cancer. 2023. DOI: 10.1136/jitc-2023-007705 (

)
Müller, M. et al., Alveolar epithelial-like cell differentiation in a dynamic bioreactor: a promising 3D-approach for the high-throughput generation of lung cell types from human induced pluripotent stem cells.
In vitro models 2, 249–262, 2023. DOI: 10.1007/s44164-023-00052-1 (

)
Zhao H. et al., Lysophosphatidic acid suppresses apoptosis of high-grade serous ovarian cancer cells by inducing autophagy activity and promotes cell-cycle progression via EGFR-PI3K/Aurora-AThr288-geminin dual signaling pathways.
Front Pharmacol. 2022. DOI: 10.3389/fphar.2022.1046269 (

)
Rodriguez-Gatica, J. E. et al., Imaging three-dimensional brain organoid architecture from meso- to nanoscale across development.
Development 15 October 2022; 149 (20): dev200439. DOI: 10.1242/dev.200439 (

)
Saskia Altmaier et al., Human iPSC-derived hepatocytes in 2D and 3D suspension culture for cryopreservation and in vitro toxicity studies. Reproductive Toxicology.
Volume 111, August 2022, Pages 68-80. DOI: 10.1016/j.reprotox.2022.05.005 (

)
Benjamin Fischer et al., A complete workflow for the differentiation and the dissociation of hiPSC derived cardiospheres.
Stem Cell Research 32 (2018) 65–72. DOI: 10.1016/j.scr.2018.08.015 (

)
Aletta Schnitzler et al., Bioprocessing of human mesenchymal stem/stromal cells for therapeutic use: Current technologies and challenges.
Biochemical Engineering Journal Volume 108, 15 April 2016, Pages 3-13. DOI: 10.1016/j.bej.2015.08.014 (

)
S Allazetta et al., Cell-Instructive Microgels with Tailor-Made Physicochemical Properties.
small 2015, 11, No. 42, 5647–5656. DOI: 10.1002/smll.201501001 (

)
※この他にも多数の論文がございます。詳細はお問い合わせください。