
[2024/12/9実施] 上記画像をクリックすると、視聴ページが開きます。お客様情報ご入力後視聴ください。
【タイトル】バリデーションされたヒト生体臓器模倣システムCN Bio社PhysioMimix®のご紹介
【要旨】
昨今の創薬研究において、以前から開発が続けられている低分子や抗体医薬、核酸医薬に加えて、細胞移植、次世代ペプチド、AIを活用した人工タンパクなど創薬モダリティは大きく変化しています。しかしながら、医薬品の開発プロセスにおける期間とコスト、そして開発成功率は依然として大きな課題となっています。
それらの課題解決のために、生体模倣システム (Micro-Physiological System: MPS)が着目されています。特にヒト細胞を用いたスフェロイドや共培養によるオルガノイドを特殊な支持体上に形成する三次元培養技術と、培養液の灌流などにより生み出されるシアストレスによって生体内環境を模倣したオーガン・オン・チップ(Organ-On-Chip: OOC)は、創薬分野における病態モデル作製、薬物スクリーニングや安全性・毒性試験、ADMEでの活用が期待されています。
本ウェビナーでは、CN Bio社が提供するMPSプラットフォームであるPhysioMimixシステムとその有用性についてご紹介します。併せて、長年の研究開発により蓄積されたCN-Bio社と共同研究者の公開データを基に、特にヒト肝臓、ヒト腸、ヒト肺を模倣したOOCの活用事例についてもご紹介できれば幸いです。 PhysioMimixシステムは使いやすいシステム構成とバリデーションされたSOPにより、これからOOCの試験運用をお考えの創薬研究者に向けて、最適なMPS環境をご提供します。

[2025/1/22実施] 上記画像をクリックすると、視聴ページが開きます。お客様情報ご入力後視聴ください。
【タイトル】CN Bio社PhysioMimix®が提供するReady-to-UseなMPS構築キットのご紹介 
【要旨】
前回のウェビナーでは、CN Bio社が提供するMPS (生体模倣システム)プラットフォームであるPhysioMimixシステムの概要とその有用性についてご紹介しました。続いて本ウェビナーでは、生体内環境を模倣したオーガン・オン・チップ(Organ-On-Chip: OOC)技術を用いて、病態モデル作製、薬物スクリーニングや安全性・毒性試験、ADMEなどin vitro細胞実験系の構築を加速するReady-to-UseなCN Bio社MPSキットについてご紹介します。
▼ご紹介製品:
1.NASH-in-a-box:ヒト非アルコール性脂肪肝炎(NASH)をin vitroで再現するためのMPS構築キット
2.Human 18 (Bioavailability assay kit):ヒト経口薬の生物学的利用能をin vitroでプロファイリングするMPS構築キット
CN Bio社は、自社における研究開発および共同研究により確立されたMPS構築のための材料およびSOPを含むキット製品を今後も続々とリリース予定です。MPS環境をより迅速に、安定して構築するためのPhysioMimixシステムとMPS構築キットを用いた統合的なソリューションの一端を、本ウェビナーでご紹介できれば幸いです。
PhysioMimix
® Coreの消耗品は、標準的な細胞培養プレートのような外観と使用感で、2Dアッセイからオーガンオンチップへの迅速な移行をサポートします。
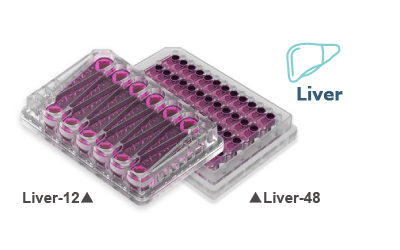
Liver プレート
(型式:MPS-LC12、MPS-LC48)
初代培養ヒト肝細胞および非実質細胞に最適な条件を提供可能なプレートです。12ウェルのLiver-12、48ウェルのLiver-48があります。
|
|
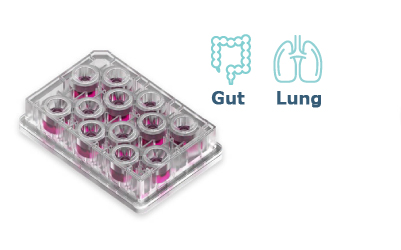
Barrier プレート
(型式:MPS-T12)
腸や肺などの、より生理学的に適切な生物学的バリアモデルを構築するためのプレートです。腎臓など他の臓器モデルにも使用可能です。
|
|
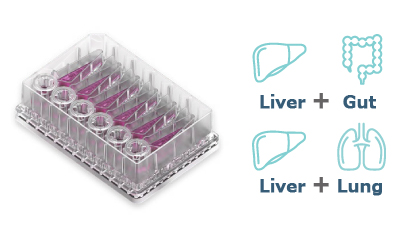
Dual-organプレート
(型式:MPS-TL6)
バリアモデルと肝臓モデルの2 臓器連結を可能にするプレートです。
|
|
 3D検証済み細胞
3D検証済み細胞
CN Bio社は、長期3D細胞培養で増殖することが検証された、生理学的に適切な細胞を特定しています。CN Bio社の3D検証済み細胞カタログから細胞を選択することで、オーガンオンチップ研究から臨床への
橋渡しが可能な、信頼性の高いデータを迅速に作成することができます。
- Primary human hepatocyte cells
- Primary human Kupffer cells
 NASH-in-a-box
NASH-in-a-box
NASH-in-a-boxには、業界で検証済みのヒトin vitro 代謝機能障害関連脂肪肝炎(Metabolic-dysfunction-associated-steatohepatitis:MASH)モデルをご自身の研究室で再現するために必要な、細胞、試薬、プレートがすべて含まれています。PhysioMimix Coreと共に使用することで、オーガンオンチップ・アプローチの迅速な導入が可能です。

疾患モデル作成
【COPD】
Advanced pathophysiology mimicking lung models for accelerated drug discovery
Thanh Huyen Phan et al., Biomaterials Research volume 27, Article number: 35 (2023)
doi. :10.1186/s40824-023-00366-x
【HBV】
3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection
A. M. Ortega-Prieto et al., Nature Communications volume 9, Article number: 682 (2018)
doi. : 10.1038/s41467-018-02969-8
【MASLD/MASH】 【Oncology】
β2-spectrin (SPTBN1) as a therapeutic target for diet-induced liver disease and preventing cancer development
Shuyun Rao et al., Sci Transl Med. 2021 Dec 15;13(624):eabk2267. doi: 10.1126/scitranslmed.abk2267.
doi. : 10.1126/scitranslmed.abk2267
【MASLD/MASH】
Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis
Michele Vacca et al., Nature Metabolism volume 2, pages514–531 (2020)
doi. :10.1038/s42255-020-0214-9
安全性・毒性学
【DILI】
Normalization of organ-on-a-Chip samples for mass spectrometry based proteomics and metabolomics via Dansylation-based assay
Erin M. Gallagher et al., Toxicology in Vitro Volume 88, April 2023, 105540
doi. :10.1016/j.tiv.2022.105540
【Immuno-medicated toxicity】
Gut-Liver physiomimetics reveal paradoxical modulation of IBD-related inflammation by short-chain fatty acids
Martin Trapecar et al., Cell Syst. 2020 Mar 25; 10(3): 223–239.e9. Published online 2020 Mar 18.
doi. : 10.1016/j.cels.2020.02.008
安全性・毒性学 / ADME
【DILI】 【Drug Metabolism】 【Drug absorption】
Multiorgan microphysiological systems as tools to interrogate interorgan crosstalk and complex diseases
Martin Trapecar, FEBS Lett. 2022 Mar;596(5):681-695.
doi. : 10.1002/1873-3468.14260
【DILI】 【Drug Metabolism】 【Drug absorption】 【General OOC】
Interconnected Microphysiological Systems for Quantitative Biology and Pharmacology Studies
Collin D. Edington et al., Scientific Reports volume 8, Article number: 4530 (2018)
doi. :10.1038/s41598-018-22749-0
【DILI】 【Immuno-medicated toxicity】 【Drug Metabolism】
Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation
Andrés Rubiano et al., Clinical and Translational Science, 2021 May;14(3):1049-1061.
doi. :10.1111/cts.12969
【Genotoxicity】
Liver-on-chip model and application in predictive genotoxicity and mutagenicity of drugs
B. Kopp et al., Mutat Res Genet Toxicol Environ Mutagen. 2024 May-Jun:896:503762. doi:10.1016/j.mrgentox.2024.503762
ADME
【Drug Metabolism】 【Drug absorption】
Application of a gut–liver-on-a-chip device and mechanistic modelling to the quantitative in vitro pharmacokinetic study of mycophenolate mofetil
Nicoló Milani et al., Lab Chip. 2022 Jul 26;22(15):2853-2868.
doi:10.1039/d2lc00276k
【Oligonucleotide delivery】
Multimodal imaging of a liver-on-a-chip model using labelled and label-free optical microscopy techniques
Jan Majer et. al., Lab Chip. 2024 Sep 24;24(19):4594-4608. doi:10.1039/d4lc00504j
 【Drug bioavailability】
【Drug bioavailability】
A primary human Gut/Liver microphysiological system to estimate human oral bioavailability
Yassen Abbas et al., Drug Metab Dispos. 2025 Sep;53(9):100130. doi:10.1016/j.dmd.2025.100130
※この他にも多数の論文がございます。詳細はお問い合わせください。