Invivoガドリニウム増強T1強調MRIおよび生物発光の補完的アッセイとしての3D高解像度蛍光イメージング
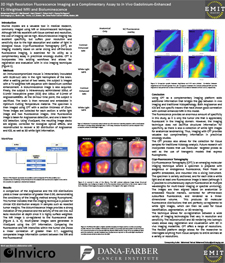
3D High Resolution Fluorescence Imaging as a Complimentary Assay to In Vivo Gadolinium-Enhanced T1-Weighted MRI and Bioluminescence | 異種移植片におけるマルチモダリティ3Dイメージングを使用したマクロファージ追跡
Macrophage tracking using multi-modality 3D imaging in xenografts | メゾスコピック分子組織イメージングデータの組み立て、再構成、可視化、および管理のための合理化されたアプローチ
A Streamline Approach for Assembly, Reconstruction, Visualization, and Management of Mesoscopic Molecular Tissue Imaging Data |
 |  |  |
Farhoud M, Brevard M, Dimant H, Holt R, Nguyen QD
| | World Molecular Imaging Congress 2020, Oct 7-9, Virtual. | | Dimant H, McConville P, Orcutt K, Holt R, Mikule K, Wilcoxen K, Lister D, Aherns ET
| | American Association of Cancer Research Annual Meeting 2020, Jun 22-24, Virtual. | | Huang W, Zakrzewksi P, Tricot B, Tobon G, Toddes S, Farhoud M
| | Bio-IT World Conference and Expo 2019, Apr 16-18, Boston. | |
| |
GFP Cryo-Fluorescence Tomography(CFT)イメージングによる心臓刺激伝導系の3D可視化
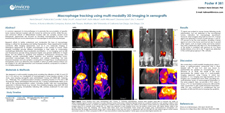
3D Visualization of the Cardiac Conduction System through GFP Cryo-Fluorescence Tomography (CFT) Imaging | 腫瘍の不均一性、転移性増殖および免疫腫瘍学の3D可視化における新しいツールとしてのクライオ蛍光トモグラフィ
Cryo-Fluorescence Tomography as a New Tool in 3D Visualization Cryo-fluorescence Tomography as a new tool in 3D visualization of tumor heterogeneity, metastatic proliferation and immuno-oncology. | 3D Ex Vivo クライオ蛍光トモグラフィ(CFT)を使用したマウス全身の腫瘍転移の視覚化
Visualizing Tumor Metastasis Throughout a Whole Mouse Using 3D Ex Vivo Cryo-Fluorescence Tomography (CFT) |
 |  |  |
Huang W, Zakrzewksi P, Tricot B , Tobon G, Toddes S, Farhoud M
| | World Molecular Imaging Congress 2018, Sep 15-18, Seattle. | | Brevard M, Farhoud M, Dimant H, Holt R, Rosenthal EL, Sahagian G, Nguyen QD
| | American Association of Cancer Research Annual Meeting 2018, Dec 4-7, Las Vegas. | | Brevard M, Fang M, Farhoud M, Holt R, Sahagian G, Dimant H
| | World Molecular Imaging Congress 2017, Sep 13-17, Philadelphia. | |
| |
クライオ蛍光トモグラフィを使用した臨床腫瘍内の抗体分布の3D評価
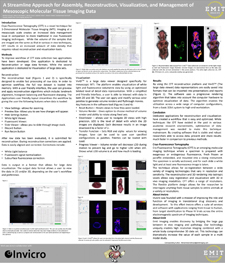
3D Assessment of Antibody Distribution within Clinical Tumors using Cryo-Fluorescence Tomography | クライオスライサー用のスタンドアロン多波長蛍光アドオンの開発と最適化
Development and Optimization of Standalone Multi-Wavelength Fluorescence Add-on for a Cryoslicer | 動物全体におけるAAV形質導入と比較したAAV生体内分布を決定するためのマルチモダリティイメージング研究
Multi-modality Imaging Study to Determine AAV Bio-Distribution Compared to AAV Transduction in Whole Animals |
 |  |  |
Dimant H, Holt RW, Polyak I, Teraphongphom NT, Kong CS, Gomez AJ, Hassan A, Hong SS, Ertsey R, Ilovich O, Rosenthal EL
| | World Molecular Imaging Congress 2017, Sep 13-17, Philadelphia. | | Holt RW, Qutaish MQ, Hesterman J, Polyak I, Diep P, Hoppin J, Frangioni JV, Verma A
| | Optical Society’s Annual Biomedical Optics Conference 2016, Apr 25-28, Fort Lauderdale. | | | Hemi Dimant, Ankit Gandhi, Rob Holt, Sanjana Pannem, Ildiko Polyak, Stefan Collins, Jacob Hesterman, Holger Patzke, Jenna Soper, Adrian Kells | |